
 ×100%即可求得氢氧化钠和所得溶液的中溶质的质量分数.
×100%即可求得氢氧化钠和所得溶液的中溶质的质量分数.
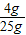 ×100%=16%;由于反应后溶液的质量是25g+24.5g=49.5g,所以反应后溶质的质量分数是
×100%=16%;由于反应后溶液的质量是25g+24.5g=49.5g,所以反应后溶质的质量分数是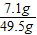 ×100%=14.3%
×100%=14.3%

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com