
| A. | 用燃磷法测定空气中氧气的体积含量 | |
| B. | 除去烧碱中混有的纯碱,可以使用稀盐酸 | |
| C. | 测定未知溶液的pH时,要先将pH试纸用水湿润 | |
| D. | 稀释浓硫酸时,向浓硫酸中缓缓加水,并用玻璃棒搅拌 |
分析 用燃磷法测定空气中氧气的体积含量能达到目的,因为磷和氧气在点燃的条件下生成白色固体五氧化二磷;除去烧碱中混有的纯碱,可以使用稀盐酸不可行,因为盐酸与烧碱和纯碱都反应;测定未知溶液的pH时,要先将pH试纸用水湿润不可行,因为湿润后相当于把溶液稀释;稀释浓硫酸时,向浓硫酸中缓缓加水,并用玻璃棒搅拌不可行,应该把浓硫酸慢慢的倒入水中.
解答 解:A、用燃磷法测定空气中氧气的体积含量能达到目的,因为磷和氧气在点燃的条件下生成白色固体五氧化二磷;故选项正确;
B、除去烧碱中混有的纯碱,可以使用稀盐酸不可行,因为盐酸与烧碱和纯碱都反应;故选项错误;
C、测定未知溶液的pH时,要先将pH试纸用水湿润不可行,因为湿润后相当于把溶液稀释,故选项错误;
D、稀释浓硫酸时,向浓硫酸中缓缓加水,并用玻璃棒搅拌不可行,应该把浓硫酸慢慢的倒入水中,故选项错误;
故选A
点评 本考点考查的是空气中氧气含量的探究实验,根据实验操作图,回忆实验中现象,由实验中的注意事项,对实验结果进行评价,从而理解该实验的探究目的.对实验结果进行评价,是近几年中考的重点之一,要好好把握.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 A、B、C、D是初中化学常见的物质,能发生如图所示的转化关系.
A、B、C、D是初中化学常见的物质,能发生如图所示的转化关系.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 药品 | 操作 | 现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
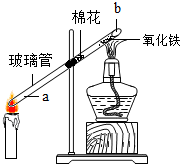
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
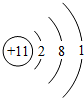 .钠在空气中极易被氧化,用小刀一切,就能观察到它的本来面目:银白色有金属光泽.钠还能与水反应,生成氢氧化钠和氢气.
.钠在空气中极易被氧化,用小刀一切,就能观察到它的本来面目:银白色有金属光泽.钠还能与水反应,生成氢氧化钠和氢气.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 利用如图所示装置(其中K1、K2是弹簧夹),验证二氧化碳的性质.
利用如图所示装置(其中K1、K2是弹簧夹),验证二氧化碳的性质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com