
| A. | 23% | B. | 32% | C. | 46% | D. | 78% |
分析 由混合物中共三种元素,由氧元素的质量分数可计算出Na、O元素的质量分数之和,根据Na2SO4、Na2SO3、Na2S三种物质中存在定组成Na2S,设出钠的质量分数来列比例式解答.
解答 解:由题意分析可知在混合物中一共有三种元素
其中氧元素含量为22%则钠元素和硫元素的含量共为78%
由化学式分析可知在混合物中钠元素和硫元素的质量比为(23×2):32=23:16
所以钠元素的质量分数为$\frac{23×2}{23×2+32}×100%$=46%.
故选C.
点评 本题考查元素的质量分数的计算,学生应能利用混合物中各物质的化学式得出定组成是解答本题的关键,明确定组成中质量比与相对原子质量的关系即可解答.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
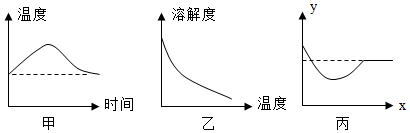
| A. | 溶质的质量与时间的关系 | B. | 溶剂的质量与时间的关系 | ||
| C. | 溶质的溶解度与时间的关系 | D. | 溶质的质量分数与时间的关系 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
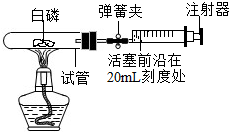 选用实际容积为40mL的试管作反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管口,通过导管与实际容积为60mL且润滑性很好的针筒注射器相连组成如下图的实验装置.假设此实验能按照小华的设想正常进行,白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:
选用实际容积为40mL的试管作反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管口,通过导管与实际容积为60mL且润滑性很好的针筒注射器相连组成如下图的实验装置.假设此实验能按照小华的设想正常进行,白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
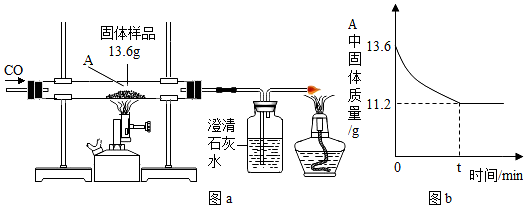
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
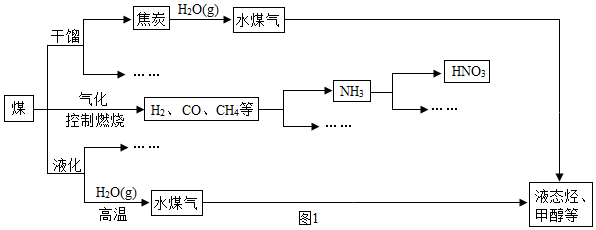
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 固体烧碱要密封存放 | |
| B. | 浓硫酸露置于空气中会增重、变稀 | |
| C. | 浓盐酸露置于空气中会变轻、变稀 | |
| D. | 铝制品耐腐蚀的原因是铝在空气中表面形成致密的氧化膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com