
 ,
,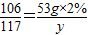 ,
,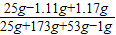 ×100%≈10%;
×100%≈10%;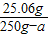 ×100%=20%,
×100%=20%,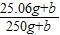 ×100%=20%,
×100%=20%,

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:初中化学 来源: 题型:
将25g混有氯化钙的食盐放入173g水里,完全溶解后再加入53g溶质质量分数为2%的碳酸钠溶液,能反应的物质都恰好完全反应。试求:
⑴原食盐中混有氯化钙的质量;
⑵反应后所得溶液中溶质的质量分数(计算结果保留整数)
⑶为了使所得溶液溶质质量分数达到20%,应采取什么措施?并计算其结果。(只要求用一种方法即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com