
| 温度/℃ | FeSO4 | (NH4) 2SO4 | xFeSO4·y(NH4)2SO4·zH2O |
| 10 | 20.0 | 73 | 17.2 |
| 20 | 26.5 | 75.4 | 21. 6 |
| 30 | 32.9 | 78 | 28.1 |



|
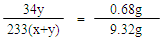
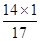 ×100%)=0.56g。
×100%)=0.56g。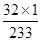 ×100%)=1.28g。
×100%)=1.28g。

科目:初中化学 来源:不详 题型:计算题
| | 第1次 | 第2次 | 第3次 |
| 样品质量(g) | 25 | 30 | 25 |
| 盐酸质量(g) | 200 | 100 | 100 |
| 所得溶液质量(g) | 216 | 116 | 116 |

查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 实 验 内 容 | 现 象 | 结 论 |
| (1)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,静置一段时间后,滴加 。 | 廉价珍珠粉的上层清液变红,优质珍珠粉的溶液没有变色 | 猜想①成立 |
| (2)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,过滤, ,加热。 | 优质珍珠粉的溶液有黄色出现,局部变黑,廉价珍珠粉的溶液没有明显现象 | 猜想 成立 |
| | 优质珍珠粉 | 廉价珍珠粉 |
| 珍珠粉的质量 | 100g | 100g |
| 加入盐酸的质量 | 460.0g | 500g |
| 烧杯中最终物质的总质量 | 520.0g | 558.2g |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.7.4% | B.10% | C.8% | D.11.1% |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 实验 | 1 | 2 | 3 | 4 | 5 |
| 样品质量/g | 13 | 13 | 13 | 13 | 13 |
| 加入盐酸质量/g | 15 | 30 | 80 | 130 | 150 |
| 反应后物质质量/g | 28 | 43 | 90.8 | 138.6 | 158.6 |

查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 实验序号 | 1 | 2 | 3 | 4 |
| 稀盐酸的质量(g) | 5 | 5 | 5 | 5 |
| 反应后烧杯内物质的质量 | 15 | 19.56 | 24.12 | 29.12 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 各物质的质量 | 第一个烧杯 | 第二个烧杯 |
| 样品质量 | 16g | 16 g |
| 稀盐酸质量 | 50g | 100g |
| 烧杯残留物质量 | 61.6 g | 109.4g |
| 产生的CO2质量 | | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com