

| 106 |
| 44 |
| x |
| 4.4g |
| 73 |
| 44 |
| y×10% |
| 4.4g |
| 10.6g |
| 11g |


科目:初中化学 来源: 题型:
| A、Mg | B、Al | C、Cu | D、Zn |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
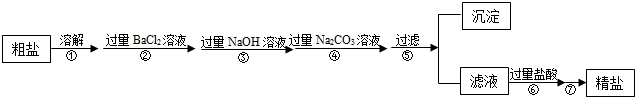
科目:初中化学 来源: 题型:
| 实验步骤 | 实验现象 | 有关的化学方程式 |
| 取少量待检溶液于试管中,滴加足量的稀盐酸 | 有气泡产生 |
| 探究的目的 | 探究的步骤 | 主要的现象 |
| 除尽溶液中的CO32- | 取少量溶液于试管中,滴加足量的①溶液 | 有白色沉淀产生 |
| 验证是否有氢氧化钠 | 向上述实验所得溶液中滴加2-3滴酚酞试液 | 酚酞试液不变色 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com