
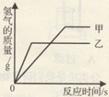
等质量的甲、乙两种金属分别与足量的溶质质量分数相同的稀硫酸反应,产生氢气的质量与反应时间的函数关系如图所示。下列相关判断中,错误的是
A.金属活动性甲比乙强
B.若甲是铁,则乙可能是锌;若甲是铝,则乙可能是镁
C.若稀硫酸的质量相等,则甲反应后所得溶液质量比乙大
D.若将相同质量的两种金属都放入足量的硫酸铜溶液中,则甲置换出铜的质量一定比乙多
科目:初中化学 来源: 题型:阅读理解


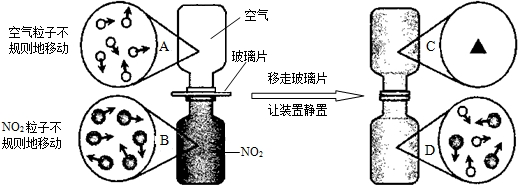
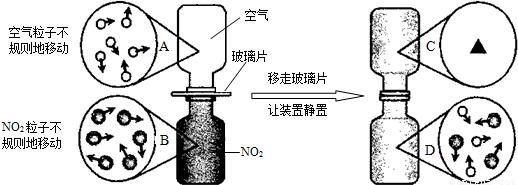
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?金牛区一模)如图是甲乙两种固体物质的溶解度曲线.据图回答:
(2012?金牛区一模)如图是甲乙两种固体物质的溶解度曲线.据图回答:查看答案和解析>>
科目:初中化学 来源:2012-2013学年北京市房山区九年级上学期期末考试化学试卷(解析版) 题型:填空题
(8分)人类的生产、生活离不开金属。
(1)用铜制电线主要是利用铜具有良好的 性。
(2)人们常用“铜墙铁壁”来形容物体的坚固。但铁在一定条件下也能发生各种反应,
如铁丝在氧气中燃烧,反应的化学方程式是________________________________。
(3)铁制品锈蚀,实际上是铁跟空气中的 发生了化学反应。防止铁制栏杆锈
蚀的一种方法是 ________________________ 。
(4)根据下图所示回答:滤渣中一定有的金属是 ____ ,滤渣与稀硫酸反应的化学方
程式为_______________________________________。

(5)把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的锌、铁两种金
属,反应后金属都没有剩余,产生氢气的质量随反应时间变化曲线如图。下列说法
正确的是___________。(填字母序号)

A.甲是铁,乙是锌
B.铁消耗硫酸的质量比锌大
C.参加反应的锌的质量小于铁的质量
D.充分反应后,稀硫酸一定都有剩余
查看答案和解析>>
科目:初中化学 来源: 题型:
人类的生产、生活离不开金属。
(1)用铜制电线主要是利用铜具有良好的 性。
(2)人们常用“铜墙铁壁”来形容物体的坚固。但铁在 一定条件下也能发生各种反应,
一定条件下也能发生各种反应,
如铁丝在氧气中燃烧,反应的化学方程式是________________________________。
(3)铁制品锈蚀,实际上是铁跟空气中的 发生了化学反应。防止铁制栏杆锈
蚀的一种方法是 ________________________ 。
(4)根据下 图所示回答:滤渣中一定有的金属是 ____ ,滤渣与稀硫酸反应的化学方
图所示回答:滤渣中一定有的金属是 ____ ,滤渣与稀硫酸反应的化学方
程式为_______________________________________。
 |
(5)把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的锌、铁两种金
属,反应后金属都没有剩余,产生氢气的质量随反应时间变化曲线如图。下列说法
正确的是___________。(填字母序号)
A.甲是铁,乙是锌
B.铁消耗硫酸的质量比锌大
C.参加反应的锌的质量小于铁的质量
D.充分反应后,稀硫酸一定都有剩余

查看答案和解析>>
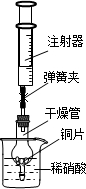
科目:初中化学 来源:2010-2011学年黑龙江省大庆三十二中九年级(下)第一次月考化学试卷(解析版) 题型:解答题


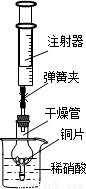
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com