
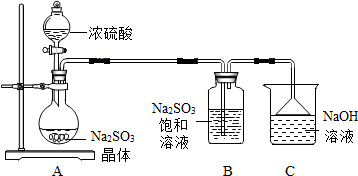
分析 (1)根据常见仪器的名称进行分析;
(2)根据反应物、生成物、质量守恒定律进行书写即可;
(3)根据若滴加浓硫酸过快,则生成二氧化硫气体较快进行分析;
(4)根据氧气的化学性质进行分析.
解答 解:(1)图中盛放浓硫酸的仪器的名称为分液漏斗;故填分液漏斗;
(2)反应过程中产生有害气体二氧化硫,需要进行尾气处理,二氧化硫与二氧化碳性质相似,与氢氧化钠反应生成相应的盐和水;反应的化学方程式为:SO2+2NaOH═Na2SO3+H2O;故填:SO2+2NaOH═Na2SO3+H2O
(3)若滴加浓硫酸过快,则生成二氧化硫气体较快,可能导致二氧化硫气体来不及与B中的亚硫酸钠进一步反应生成Na2S2O5;故填:防止生成二氧化硫气体过快,来不及与B中的亚硫酸钠进一步反应生成Na2S2O5;
(4)该实验开始滴加浓硫酸时,应先除尽装置内的空气,是为了防止Na2S2O5被氧化成Na2SO4,这里反映了氧气的氧化性;故填:氧化性.
点评 本题考查物质的制备实验、对装置的分析评价、实验方案设计、物质含量的测定、氧化还原反应滴定等,明确实验原理是解本题关键,是对学生综合能力的考查.


科目:初中化学 来源: 题型:解答题
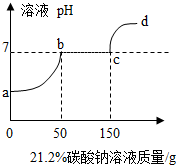 往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:
往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 甲、乙、丙和X、Y、Z都是初中化学中常见的物质,甲、乙、丙都是氧化物,且常温下甲固体,乙是气体,丙是液体.在一定条件下,甲、乙、丙之间存在如图所示的转化关系(反应条件和部分生成物已略去).下列判断正确的是( )
甲、乙、丙和X、Y、Z都是初中化学中常见的物质,甲、乙、丙都是氧化物,且常温下甲固体,乙是气体,丙是液体.在一定条件下,甲、乙、丙之间存在如图所示的转化关系(反应条件和部分生成物已略去).下列判断正确的是( )| A. | 甲一定是CuO | B. | X一定具有还原性 | ||
| C. | Z一定是酸 | D. | Y和Z一定能发生反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 操作 | 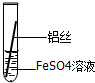 甲 | 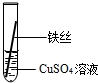 乙 | 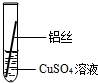 丙 | 根据现象得出金属活动性顺序 |
| 现象 | 铝丝表面附着银白色固体 | 铁丝表面附着红色固体 | 铝丝表面附着红色固体 | Al>Fe>Cu |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
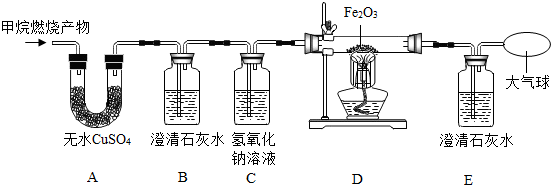
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 阳离子 阴离子 | OH- | CL- | SO2−4 | CO2−3 |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 不 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 不 |
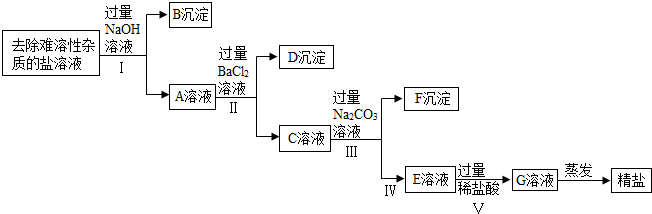
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
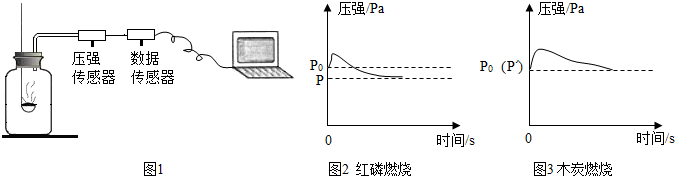
| A. | 燃烧匙内所装红磷或木炭的多少对实验结果无影响 | |
| B. | 反应开始时集气瓶中压强瞬间变大的是由燃烧放热造成的 | |
| C. | p=0.79p0,p′=p0是因为红磷的着火点比木炭低 | |
| D. | 由图3可推出空气中氧气的含量 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水、AgNO3溶液、稀硝酸 | B. | 水、NaOH溶液、稀盐酸 | ||
| C. | 水、KOH溶液、稀盐酸 | D. | 水、KOH溶液、稀硫酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
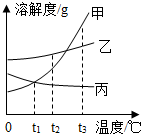 如是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.
如是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com