
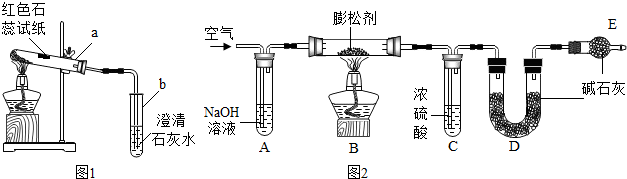
| ||
| ||
| 实验操作 | 主要实验现象 | 实验结论 及解释 | |
| ① | 检查装置的气密性 | 装置的气密性良好 | |
| ② | 点燃酒精灯 | 试管中白色固体减少,红色石蕊试纸 | 有二氧化碳和氨气生成 |
| ③ | 继续充分加热 | 试管中仍有固体. | |
| ||
| 17 |
| 1.36g |
| 79 |
| x |
| 17 |
| 1.36g |
| 44 |
| y |
| ||
| 168 |
| 1.68g |
| 44 |
| z |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:初中化学 来源: 题型:
| 实验步骤 | 实验现象 | 结 论 |
| 甲:取少量该溶液放入试管中, 滴加几滴酚酞试液 |
溶液变红 | 该溶液没有变质 |
| 乙:取少量该溶液放入试管中加入 一定量澄清石灰水 |
产生白色沉淀 | 该溶液已经变质.产生沉淀 的化学方程式为 |
| 丙:取少量该溶液放入试管中加入 一定量稀盐酸 |
该溶液已经变质 |
查看答案和解析>>
科目:初中化学 来源: 题型:
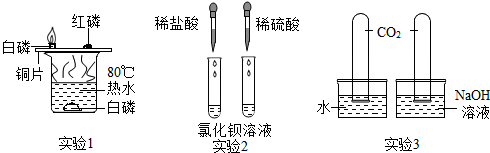
查看答案和解析>>
科目:初中化学 来源: 题型:
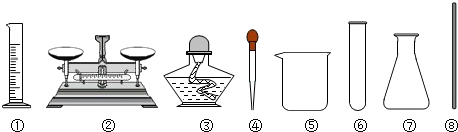
查看答案和解析>>
科目:初中化学 来源: 题型:
 根据金属活动顺序表的有关知识,回答下列问题:
根据金属活动顺序表的有关知识,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com