
 生活中常见的铁制品大多为铁合金(成分为铁和碳)材料,而非纯铁,铁合金又因其含碳量不同分为生铁和钢(生铁含碳量为2%-4.3%,钢含碳量为0.03%-2%).将一块质量为5.8g的铁合金放入烧杯中,再向烧杯中加入98g稀硫酸,反应关系如图所示:通过计算回答:该铁合金是生铁还是钢?(写出计算过程,结果精确到0.1%)
生活中常见的铁制品大多为铁合金(成分为铁和碳)材料,而非纯铁,铁合金又因其含碳量不同分为生铁和钢(生铁含碳量为2%-4.3%,钢含碳量为0.03%-2%).将一块质量为5.8g的铁合金放入烧杯中,再向烧杯中加入98g稀硫酸,反应关系如图所示:通过计算回答:该铁合金是生铁还是钢?(写出计算过程,结果精确到0.1%)  小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:初中化学 来源: 题型:选择题
| A. | 乙酸乙酯完全氧化后生成二氧化碳和水 | |
| B. | 乙酸乙酯由碳、氢、氧原子构成 | |
| C. | 乙酸乙酯中碳、氧元素的质量比为2:1 | |
| D. | 乙酸乙酯是由碳、氢、氧元素组成的氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 某兴趣小组为了测定鸡蛋壳(主要成分是碳酸钙)中碳酸钙的含量,现取7.8g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入47.2g某浓度的稀盐酸,恰好完全反应(鸡蛋壳中除碳酸钙外,其他成分不与稀盐酸反应也不溶于水),测得烧杯中的反应剩余物的质量与反应时间的关系如图所示(忽略水分的蒸发).
某兴趣小组为了测定鸡蛋壳(主要成分是碳酸钙)中碳酸钙的含量,现取7.8g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入47.2g某浓度的稀盐酸,恰好完全反应(鸡蛋壳中除碳酸钙外,其他成分不与稀盐酸反应也不溶于水),测得烧杯中的反应剩余物的质量与反应时间的关系如图所示(忽略水分的蒸发).查看答案和解析>>
科目:初中化学 来源: 题型:选择题
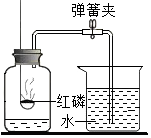
| A. | 不能用木炭代替红磷 | |
| B. | 燃烧匙中盛放过量的红磷 | |
| C. | 通过实验可以得出空气中氮气与氧气的体积比约为5:1 | |
| D. | 氮气不与红磷反应且难溶于水,是设计该实验的依据之一 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图是常见的电源插头
如图是常见的电源插头查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 如图是某胃药标签的部分内容.晓彤同学测定该药品中NaHCO3含量的过程如下:取10粒该药剂研碎后放入烧杯中,加入50g水后充分搅拌,再向其中滴加稀盐酸至溶液的pH=7时(已知药品中的其它成分既不溶于水,也不与稀盐酸反应),形成NaCl的不饱和溶液,共消耗稀盐酸11.5g,称得反应后烧杯内物质的总质量为64.3g.请计算:
如图是某胃药标签的部分内容.晓彤同学测定该药品中NaHCO3含量的过程如下:取10粒该药剂研碎后放入烧杯中,加入50g水后充分搅拌,再向其中滴加稀盐酸至溶液的pH=7时(已知药品中的其它成分既不溶于水,也不与稀盐酸反应),形成NaCl的不饱和溶液,共消耗稀盐酸11.5g,称得反应后烧杯内物质的总质量为64.3g.请计算:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除去杂质的方法 |
| A | N2 | O2 | 将气流通过灼热的铜网 |
| B | NaCl固体 | 硫酸钠 | 溶解,加入适量BaCl2溶液,充分反应后过滤,洗涤,干燥 |
| C | Cu(NO3)2溶液 | AgNO3 | 加入足量铜粉,充分反应后过滤 |
| D | CaCl2溶液 | HCl | 加入足量CaCO3粉末,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com