
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液钮中上层清液于试管中,加入过量氯化钙溶液,静置. | 猜想l正确 | |
| 没有白色沉淀,溶液呈红色 | 猜想2正确 | |
| 猜想3正确 |
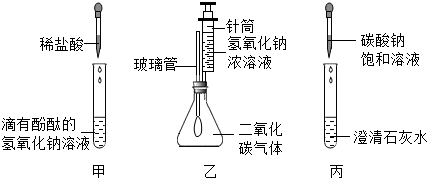
分析 Ⅰ.①根据稀盐酸与氢氧化钠的反应分析,写出反应的方程式;
②根据氢氧化钠与二氧化碳的反应及锥形瓶内压强的变化分析;
③碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,
Ⅱ.【讨论交流】
①根据几种反应的生成物考虑;
②根据使废液呈碱性的物质有氢氧化钠、氢氧化钙、碳酸钠等分析.
【实验设计】根据氯化钙的性质分析设计实验.
③根据氢氧化钙与二氧化碳、碳酸钠等反应的性质分析加入的试剂和预计的现象;
解答 解:Ⅰ.①在甲实验过程中,稀盐酸与氢氧化钠发生了中和反应,溶液碱性减弱,溶液的红色逐渐消失,该反应的化学方程式是NaOH+HCl=NaCl+H2O;
②乙实验中滴加氢氧化钠溶液,二氧化碳被氢氧化钠溶液吸收,瓶内压强减低,在外界大气压的作用下,气球膨胀起来;二氧化碳和氢氧化钠反应产生碳酸钠和水,反应的方程式为:2NaOH+CO2=Na2CO3+H2O;
③碳酸钠和氢氧化钙反应的反应物是碳酸钠和氢氧化钙,写在等号的左边,生成物是碳酸钙沉淀和氢氧化钠写在等号的右边,碳酸钙后面标上沉淀符号,所以方程式是:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
Ⅱ.①由于盐酸与氢氧化钠反应生成了氯化钠,而氯化钠显中性又不易和其它物质反应,所以一定含有氯化钠;
②使废液呈碱性的物质有氢氧化钠、氢氧化钙、碳酸钠,溶液中不能剩氢氧化钙和碳酸钠,因为二者继续反应,所以只有还有可能是氢氧化钠和氢氧化钙了.所以.我的猜想是氢氧化钙.
【实验设计】
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置. | ①有白色沉淀,溶液由红色变为无色. | 猜想1正确. |
| ②没有白色沉淀,溶液呈红色. | 猜想2正确 | |
| ③有白色沉淀,溶液呈红色. | 猜想3正确. |
点评 通过回答本题知道了碳酸根的检验方法,掌握了在分析化学反应后所得物质的成分时不仅考虑生成物有什么,还需要考虑反应物中什么物质过量问题.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 牛肉 | B. | 河虾 | C. | 青菜 | D. | 雪糕 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com