
【题目】实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小科用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如下表,请分析计算:)
实验组别 | 一 | 二 | 三 | 四 |
稀盐酸质量/g | 100.0 | 100.0 | 100.0 | 100.0 |
混合物质量/g | 3.0 | 6.0 | 9.0 | 12.0 |
所得溶液质量/g | 101.9 | 103.8 | 105.0 | a |
剩余固体质量/g | 0 | 0 | m | n |
(1)原混合物中碳酸钙与氯化钙的质量比为_____________;
(2)求表中m的值____________ (要求写出完整的过程)。
【答案】5:1 1.25
【解析】
根据图表中数据分析,每消耗3.0g混合物,溶液增加1.9g,第三次加入混合物9.0g,溶液增加质量为5.0g,小于1.9g×3,说明混合物剩余,稀盐酸完全反应,第一、二组稀盐酸还有剩余。由于第三组混合物剩余,稀盐酸完全反应。
(1)由第一组数据可知,生成二氧化碳的质量为100.0+3.0g-101.9g=1.1g.
设3.0g混合物中碳酸钙的质量为x 。
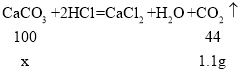
![]()
x=2.5g
混合物中碳酸钙和氯化钙质量之比为2.5g:(3.0g-2.5g)=5:1。
(2)第三组中产生二氧化碳的质量为100.0g+9.0g-105.0g-m=4.0g-m。
设反应的碳酸钙的质量为y
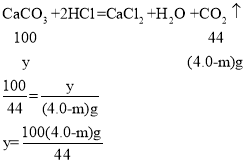
9.0g混合物中的碳酸钙质量=![]() ,m=1.25。
,m=1.25。
答:(1)混合物中碳酸钙和氯化钙质量之比为5:1。
(2)表中m的值为1.25。


科目:初中化学 来源: 题型:
【题目】下图为初中常见的实验,请回答与实验相关的问题。
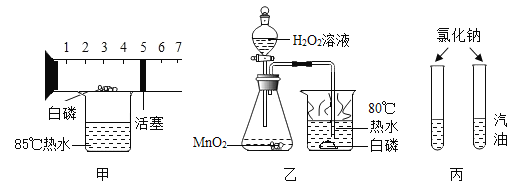
(1)用装置甲测空气中氧气含量,关于该实验下列说法正确的是_____(填序号)。
A 白磷量不足,会导致测量结果大于1/5
B 实验现象为:白磷燃烧时产生大量的白色烟雾,最终活塞停留在刻度4附近
C 该实验中,若将装热水的烧杯换成酒精灯,则白磷可用硫粉代替
D 相比教材中的装置,该装置更环保,测量误差更小
(2)乙实验可用于探究燃烧需要的部分条件,请写出锥形瓶中发生反应的化学方程式_____;烧杯中热水作用为_____。
(3)丙实验的目的是探究_____对溶解性的影响。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属材料在生产生活中应用广泛。化学实验小组的同学为了解Mn、Fe、Cu三种金属的活动性顺序,进行了如下探究活动。
[作出猜想]对Mn的活动性提出了三种猜想:
猜想一、_____;猜想二、Fe>Mn>Cu;猜想三、Fe>Cu>Mn。
[实验验证]
实验步骤 | 实验方案 | 实验现象 | 实验结论 |
① |
| _____ | 猜想三错误 |
② | 将锰加入硫酸亚铁溶液中 | 有黑色固体析出 | 猜想_____正确 |
(1)步骤①的实验方案中,a和b的数值应分别是_____。
(2)已知Mn在生成物中显+2价,则步骤②中反应的化学方程式为_____。
[拓展延伸]若将步骤①和②中反应后的混合物倒入同一烧杯中,搅拌、过滤,得到固体X和溶液Y ;再向溶液Y中加入铁粉,有气泡产生。则溶液Y中溶质的成分_____(填字母)。
A 一定有FeSO4
B 一定有MnSO4
C 可能有H2SO4
D 可能有CuSO4
[反思与应用]活动性越强的金属,越容易在空气中发生化学变化。铁生锈的条件是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下图所示,已知A是赤铁矿的主要成分,E的浓溶液稀释时会放出大量的热,G溶液为蓝色,请回答下列问题:
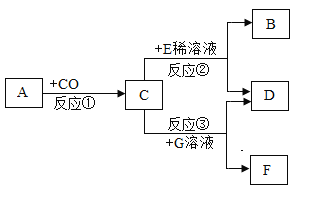
(1)写出D物质的化学式___。在反应①②③中,属于置换反应的是___(填序号)。
(2)工业上常利用反应①的原理来冶炼生铁,反应的化学方程式为___。
(3)A与E的稀溶液发生反应的方程式为____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知草酸(H2C2O4)晶体与浓硫酸共热发生化学反应:  。某化学兴趣小组同学利用如图所示的装置,正确连接装置,进行实验,可以验证m g某混合气体的成分是CO2、H2O和CO,并粗略测出每种气体的质量(每套装置限用一次,无水硫酸铜遇水分变蓝)。连接装置后先通一段时间氮气,再继续实验。下列说法正确的是:
。某化学兴趣小组同学利用如图所示的装置,正确连接装置,进行实验,可以验证m g某混合气体的成分是CO2、H2O和CO,并粗略测出每种气体的质量(每套装置限用一次,无水硫酸铜遇水分变蓝)。连接装置后先通一段时间氮气,再继续实验。下列说法正确的是:
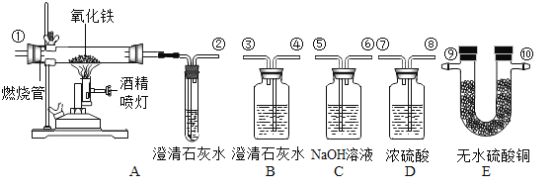
A.装置的连接顺序依次为混合气体→E→C→B→D →A→尾气处理
B.实验时应先通混合气体后点燃酒精喷灯
C.计算CO的质量时,既能根据A中燃烧管内固体减少的质量计算,也可根据A中澄清石灰水增加的质量计算,二种方法均准确
D.通过装置B、C、D在反应前后增加的总质量可以得出CO2的质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】今年是门捷列夫发现化学元素周期表150周年,第74次联合国大会宣布2019年为“国际化学元素周期表年”。下表为部分元素的原子结构示意图,请回答问题。
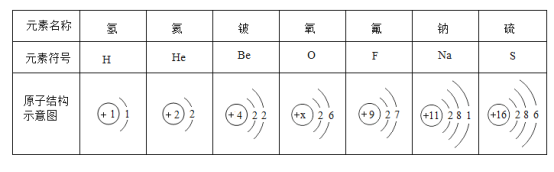
(1).上表所列的 7种元素中,位于第二周期的元素有_____种。
(2)氧原子得到电子所形成离子的离子符号为_____。
(3) 11 号与16号两种元素组成的化合物,其化学式为_____。
(4)金属铍(Be) 与铝化学性质相似,在空气中,铍的表面易形成一层氧化物保护膜,发生反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】含氮化合物是重要的化工原料。
(1)氨气是由_____(填“分子”、“原子”或“离子”)构成的。
(2)氨气溶于水显碱性,是因为氨气与水反应生成了碱,请写出这种碱的化学式_____。
(3)NH4NO3 是一种重要的氮肥,请标出 NH4NO3中氮元素的化合价_____。已知NH4NO3和KCl固体混合物中氮元素的质量分数为28%,则混合物中KCl的质量分数 为_____。
(4)请完成鉴别氯化铵和硝酸铵两种溶液的实验报告。
实验步骤 | 实验现象 | 实验结论 |
______ | ______ | ______ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象能正确反映其对应的实验操作的是
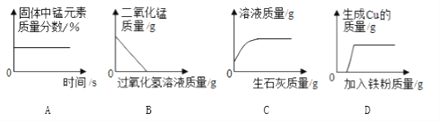
A. 加热一定量的高锰酸钾固体
B. 向一定量的MnO2中加入H2O2溶液
C. 向一定质量的饱和石灰水中加入生石灰
D. 向一定质量的AgNO3和Cu(NO3)2的混合溶液中不断加入铁粉
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组通过探究活动学习和理解化学知识。请你一起研究学习,并回答有关问题。
研究问题:水溶液中复分解反应的微观实质
相关信息:
(Ⅰ)电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小。
(Ⅱ)相同温度下同种溶液电导率越大,离子浓度越大。
(1)实验一:恒温条件下,向一定体积一定浓度的稀Ba(OH)2溶液中滴加2-3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示。
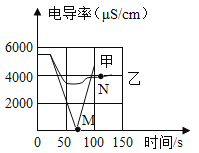
①写出Ba(OH)2与H2SO4反应的化学方程式____________。
②M点时电导率为零,离子浓度也几乎为零,此时混合液体静置后呈____________色;
③通过对甲曲线的分析,下列说法错误的是____________(填序号)。
A.M点前曲线下滑的过程中,H+和OH-结合成H2O,Ba2+和SO42-结合成BaSO4
B.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
(2)实验二:恒温条件下,向等量同浓度的稀Ba(OH)2溶液中滴加2-3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示。
①通过对乙曲线的分析,下列说法正确的是____________(填序号)。
A.实际参加反应的是Ba2+和SO42-结合成了BaSO4,Na+和OH-还是以离子形式存在于溶液中
B.溶液红色只会变浅,但不会褪去
②N点时,溶液中大量含有的离子是___________(填离子符号)。
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度____________(填“增大”或“减小”)。
(3)拓展:
①请根据示例仿写离子方程式。
示例![]() 离子方程式:
离子方程式: ![]()
仿写: ![]() 离子方程式:____________________。
离子方程式:____________________。
②向一定量饱和澄清石灰水中持续通入过量的CO2气体,溶液先变浑浊后浑浊逐渐消失。请推测此过程的溶液中Ca2+的浓度变化情况_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com