(2006?上海)矿物燃料中常含有硫元素,在燃烧过程中会产生污染环境的SO2气体,该气体可用氢氧化钙悬浊液吸收,生成难溶于水的亚硫酸钙(CaSO3)和水.
(1)亚硫酸钙(CaSO3)的摩尔质量是______,其中Ca、S、O元素的原子个数比为______;1molCaSO3中约有______个硫原子.
(2)写出吸收SO2的化学反应方程式:______
(3)根据上述化学反应,若要吸收32g SO2气体,理论上需要______mol Ca(OH)2.
【答案】
分析:(1)根据单位物质的量的物质所具有的质量,称为摩尔质量,用符号M表示.当物质的质量以克为单位时,摩尔质量的单位为g/mol,在数值上等于该物质的相对原子质量或相对分子质量,进行解答;
根据标在元素符号右下角的数字表示一个分子中所含原子的个数;进行解答;
科学上把含有6.02×10^23个微粒的集体作为一个单位,叫摩尔;
(2)根据反应物与生成物和化学方程式的写配注等,写出反应化学方程式即可;
(3)先计算32g SO
2为多少摩尔,根据方程式计算即可解答.
解答:解:(1)当物质的质量以克为单位时,摩尔质量的单位为g/mol,在数值上等于该物质的相对原子质量或相对分子质量,所以亚硫酸钙(CaSO
3)的摩尔质量为:40+32+16×3=120g/mol;
根据标在元素符号右下角的数字表示一个分子中所含原子的个数;因此CaSO
3中Ca、S、O元素的原子个数比为:1:1:3;1molCaSO
3中约有 6.02×10
23 个硫原子.
故答案为:120g/mol; 1:1:3; 6.02×10
23;
(2)氢氧化钙悬浊液吸收SO
2的化学反应方程式为:SO
2+Ca(OH)
2=CaSO
3+H
2O 或 SO
2+Ca(OH)
2=CaSO
3↓+H
2O;
故答案为:SO
2+Ca(OH)
2=CaSO
3+H
2O 或 SO
2+Ca(OH)
2=CaSO
3↓+H
2O;
(3)先计算32g SO
2为:
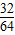
=0.5摩尔,
SO
2+Ca(OH)
2=CaSO
3↓+H
2O
1 1
0.5 X
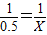
则 X=0.5 mol
故答案为:0.5 mol.
点评:本题考查了化学方程式的书写及摩尔质量的有关知识.

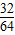 =0.5摩尔,
=0.5摩尔,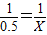 则 X=0.5 mol
则 X=0.5 mol

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
 (2006?上海)选做题:某学生在学习CO2的化学性质及实验室制法的原理后,联想起在实验室中用H2O2制取O2的实验.
(2006?上海)选做题:某学生在学习CO2的化学性质及实验室制法的原理后,联想起在实验室中用H2O2制取O2的实验.