
【题目】烧碱是一种重要的化工原料,广泛应用于制取肥皂,以及石油、造纸、纺织和印染等工业。
(1)新冠肺炎疫情期间常用的84消毒液的制备离不开烧碱,84消毒液的主要成分是次氯酸钠(NaClO)。烧碱能制备次氯酸钠是因为烧碱能与氯气反应:2NaOH+Cl2=NaClO+X+H2O,其中X的化学式为_____。用途广泛的烧碱还有很多性质,如图表示烧碱与相关物质的关系(箭头表示物质间能转化,实线表示物质间能反应),请回答:
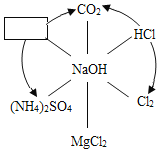
①![]() 中物质的化学式为
中物质的化学式为
②图中物质间发生中和反应的化学方程式为:_____(写出一个即可)。
(2)如图为某化工厂利用苛化法生产烧碱的流程图。“碱泥”曾经是该化工厂最头疼的一种废物,占地堆放对环境造成不利影响。工厂技术人员经过技术革新,变废为宝,使“碱泥”变成了副产品,既解决了占地与环境污染问题,又增加了工厂收入。请分析流程图并回答:
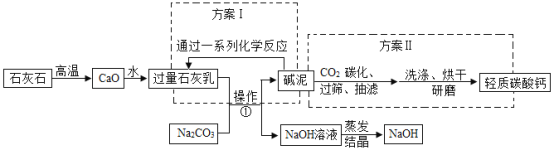
①操作的名称是_____。
②方案Ⅰ的系列反应不涉及的基本反应类型是_____(填序号)。
A化合反应B分解反应C置换反应D复分解反应
③“碱泥”与CO2反应生成碳酸钙的化学方程式为:_____。
④写出图中反应①的化学方程式_____。
【答案】NaCl H2SO4 NaOH+HCl=NaCl+H2O 过滤 C Ca(OH)2+CO2=CaCO3↓+H2O Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
【解析】
![]() 反应前有2个钠原子,2个氧原子,2个氢原子,和2个氯原子,反应后现有1个钠原子,1个氯原子,2个氧原子和2个氢原子,还有有1个氯原子和1个钠原子,组成物质为NaCl;
反应前有2个钠原子,2个氧原子,2个氢原子,和2个氯原子,反应后现有1个钠原子,1个氯原子,2个氧原子和2个氢原子,还有有1个氯原子和1个钠原子,组成物质为NaCl;
![]() 、该物质可以氢氧化钠反应,又能生成二氧化碳,说明显酸性,同时生成硫酸铵,则含有硫酸根,所以为硫酸;化学式为:
、该物质可以氢氧化钠反应,又能生成二氧化碳,说明显酸性,同时生成硫酸铵,则含有硫酸根,所以为硫酸;化学式为:![]() 。
。
![]() 、盐酸与氢氧化钠反应生成氯化钠和水,符合中和反应的特点;反应的化学方程为:
、盐酸与氢氧化钠反应生成氯化钠和水,符合中和反应的特点;反应的化学方程为:![]() ;
;
![]() 、经过操作后实现了固液分离,所以常用的方法为过滤;
、经过操作后实现了固液分离,所以常用的方法为过滤;
![]() 、石灰石分解为分解反应,氧化钙与水反应为化合反应,石灰乳与碳酸钠反应为复分解反应,所以未涉及的反应为置换反应;
、石灰石分解为分解反应,氧化钙与水反应为化合反应,石灰乳与碳酸钠反应为复分解反应,所以未涉及的反应为置换反应;
![]() 、碱泥中含有过滤的氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙和水,反应的化学方程为:
、碱泥中含有过滤的氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙和水,反应的化学方程为:![]() ;
;
![]() 、氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠,反应的化学方程为:
、氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠,反应的化学方程为:![]() 。
。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:初中化学 来源: 题型:
【题目】某纯碱样品中含有少量NaCl,小华同学取该样品23g全部溶解于200水中,再逐滴加入160g稀盐酸。反应中产生气体的质量与盐酸的用量关系如图所示。
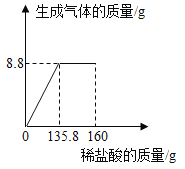
(1)产生的二氧化碳的质量是_____克;
(2)样品中碳酸钠的质量为多少克?
(3)此时所得到的溶液中氯化钠的质量分数为多少?(结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2017年5月,中国首架无人机C919客机在浦东机场首飞成功。回答问题:
(1)选用铝合金做飞机机身而不选用纯铝,主要原因是铝合金硬度和强度_______(填“大于”或“小于”) 纯铝。铝抗腐蚀性强的原因___________(用化学方程式表示)。

(2)材料对我们的生活影响越来越大,钛合金属于_______。
A 合成材料 B 金属材料 C 复合材料 D 天然材料
(3)小军同学为了探究几种金属的性质,做了下列四个实验:
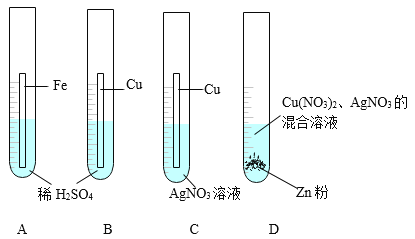
① 通过A中有气泡产生、B中__________、C中______________________的现象,可探究出Cu、Fe、Ag的金属活动性强弱为__________________。
② D中物质充分反应后过滤,滤液仍为蓝色,下列说法正确的是________(填字母)。
A 滤渣一定有银,一定没有铜和锌
B 滤渣一定有银,可能有铜,一定没有锌
C 滤液中一定有Cu2+,可能有Zn2+和Ag+
D 滤液中一定有Cu2+和Zn2+,可能有Ag+
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器,欲利用其进行下列化学实验。
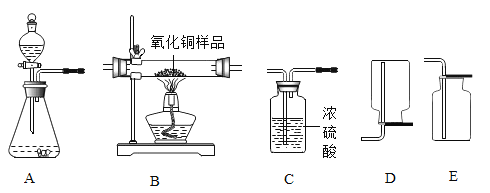
(1)以锌和稀硫酸为原料,制取并收集干燥的氢气
①所选仪器的连接顺序为_____(从左到右填写仪器序号字母)。
②生成氢气时,装置A中所发生反应的化学方程式为_____。
③装置A中使用分液漏斗的优点除节的药品外,还有_____(写一条即可)。
④反应结束后,装置A中溶液的pH与之前相比_____(填“增大”“减小”“不变”“无法判断”之一)。
⑤下列关于氢气的叙述不正确的是_____(选填下列序号之一)。
A 氢气作燃料的优点是燃烧热值高,产物无污染
B 保持氢气化学性质的最小微粒是氢原子
C 点燃氢气前,一定要检验氢气的纯度
D 氢气除用排空气法收集外,还可以用排水法收集
(2)若用锌和稀硫酸反应制取氢气,并用来测定某20g不纯氧化铜样品的纯度(杂质不反应),仪器连接顺序为:A→C1→B→C2→C3(已知![]() ;C1、C2、C3为三个盛浓硫酸的洗气瓶)。
;C1、C2、C3为三个盛浓硫酸的洗气瓶)。
①在该装置连接中,洗气瓶C1、C2的作用分别是_____。
②装置B中大玻璃管内的现象是_____。
③若经过充分反应,测得反应前、后洗气瓶C2的质量增加3.6g,则原氧化铜样品中氧化铜的纯度是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲.乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是
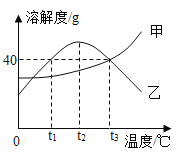
A.乙的溶解度大于甲的溶解度
B.t2℃时,乙的饱和溶液升温或降温均会析出晶体
C.甲溶液从t3℃降温到t1℃,甲溶液中的溶质质量分数会变小
D.t3℃时,50g水中加入40g的甲物质充分溶解可得到90g甲的饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人们已经知道,由碳元素形成的单质和化合物的种类是所有元素中最多的。我们在初中阶段已经接触到的含碳物质就有好多种,如:①金刚石、②石墨、③CO、④CO2、 ⑤Na2CO3 等,还有很多有机物。随着科学的发展,许多报刊还陆续报道了新发现的: ⑥C60、⑦C3O2、⑧C4O3、⑨C5O3、⑩C12O9 等。请分析上述材料并回答下列问题:
(1)其中属于碳的单质的有(填序号)_____,属于碳的氧化物的有(填序号) ___。
(2)如果某碳的氧化物中含氧量为 50%,写出由 C 和 CO2 在高温下化合为该碳的氧化物的化学方程式______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有质量相等的两种金属单质分别和质量相等、溶质质量分数也相等的 稀盐酸反应,反应情况如图所示。则下列情况中不可能存在的是
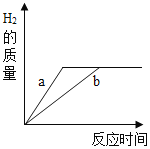
A.盐酸均反应完,金属均有剩余
B.有一种金属反应完,与此金属反应的盐酸有剩余
C.曲线 a、b 分别表示锌、铁的反应情况或镁、铝的反应情况
D.若两种金属是铁和铝,盐酸均反应完,铁也恰好完全反应,铝有剩余
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是( )
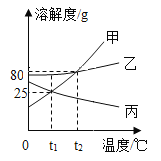
A.t1℃时,甲、乙、丙三种物质的溶解度由大到小顺序为甲=丙<乙
B.t2℃时,乙物质的溶解度为80g
C.将t2℃时80g甲的饱和溶液降温到t1℃,析出晶体的质量为55g
D.t2℃时等质量饱和甲、乙、丙溶液降温到t1℃时,所得三种溶液的质量由大到小顺序为丙>乙>甲
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(FeSO47H2O)古称绛矾,《新修本草》记载“绛矾本来绿色,新出窑未见风者。烧之赤色,故名绛矾矣”。课外小组的同学对其变色产生兴趣,开展如下探究活动。
(查阅资料)
ⅰ.含有Fe3+的盐溶液遇KSCN溶液会变红。
ⅱ.保存FeSO4溶液时要加入稀硫酸和铁钉,置于阴凉处。
(进行实验)
实验1:分别取等量10% FeSO4溶液进行下列三组实验
序号 | ① | ② | ③ |
操作 |
|
|
|
实验现象 | 溶液逐渐变为黄色 | 更长时间后溶液变为黄色 | 溶液颜色不变 |
实验2:分别取等量10% FeSO4溶液进行下列四组实验
编号 | A | B | C | D | |
实验 内容 |
|
|
|
| |
现象 | 30min | 变黄 | 不变色 | 变黄 | 不变色 |
2h | 黄色加深 | 不变色;滴加KSCN溶液,略显红色 | 黄色加深 | 不变色;滴加KSCN溶液,无明显现象 | |
实验3:如图所示,取10%的Fe2(SO4)3溶液20mL于小烧杯中,加入一定量铁粉,搅拌,观察到铁粉减少,溶液变为浅绿色。
回答下列问题:
(1)实验1的探究了__________个问题。其问题之一是_____________
(2)探究2的B实验中,FeSO4溶液变质的反应如下,补全该反应的化学方程式。
4FeSO4+ 2H2SO4+ O2=2Fe2(SO4)3+_______
(3)实验3探究铁钉在抑制硫酸亚铁变质中所起的作用,原理用化学方程式表示为__________。
(4)从实验结果看,单纯向FeSO4溶液中放入铁钉,________(填“能”或“不能”)抑制FeSO4变质。
(5)向硫酸亚铁溶液中加入稀硫酸能抑制其变质,得出此结论的依据是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com