
写出下列反应的化学方程式,并注明反应类型
①金属钠与水反应生成烧碱和一种常见的气体单质;  (反应类型 )
(反应类型 )
②一氧化碳和氧化铁反应 (反应类型 )
③碱式碳酸铜受热 (反应类型 )
④硫酸铵溶液和氢氧化钠溶液 (反应类型 )
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:初中化学 来源: 题型:
 定量研究是科学研究的重要方法之一,利用它能解决许多生产生活中的实际问题.
定量研究是科学研究的重要方法之一,利用它能解决许多生产生活中的实际问题.
(1)将20g质量分数为4%的氢氧化钠溶液与7.3g稀盐酸混合,恰好完全反应,所得溶液的pH为7,试计算所用稀盐酸的溶质质量分数?
(2)实验室浓盐酸(分析纯)的溶质质量分数在36%~38%之间为合格药品。(1)题中的稀盐酸是用一定体积(折算成质量为2g)的浓盐酸(分析纯)加水配制而成的。通过计算判断该浓盐酸是否为合格药品。
查看答案和解析>>
科目:初中化学 来源: 题型:
已知在水溶液中,乙醇(C2H5OH)不发生电离,溴化氢(HBr)电离产生氢离子(H+)和溴离子(Br-),氢氧化钠电离产生钠离子和氢氧根离子。请回答下列问题:
(1)根据这三种溶液的组成推断,医用酒精(含乙醇75%的水溶液)显 (填“酸性”、 “中性”或“碱性”);
(2)写出上述物质之间发生中和反应的化学方程式 ;
(3)氢氧化钠溶液中存在的微粒有(用化学符号表示) 。
查看答案和解析>>
科目:初中化学 来源: 题型:
甲和乙反应可制备燃料丙,其微观示意图如下。下列说法错误的是

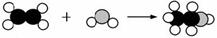 氢原子
氢原子
 碳原子
碳原子
|
A.该反应属于化合反应 B.该反应中分子和原子的种类都发生了改变
C.甲、丙是有机物,乙是氧化物 D.甲、丙分别在氧气中完全燃烧,产物相同
查看答案和解析>>
科目:初中化学 来源: 题型:
下图是a、b、c三种物质的溶解度曲线,下列分析正确的是
A.t1 ℃时,100g a物质饱和溶液中含有20g a物质
B.t2 ℃时a、c两种物质的饱和溶液中溶质相等
C.将t2 ℃时a、b、c三种物质的饱和溶液降温至t1 ℃时,
所得溶液的溶质质量分数关系是b >a 〉 c
D.a物质中含有少量的b物质,可采用冷却热饱和溶液的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
根据右图的有关信息判断,下列说法正确的是( )
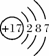


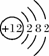 A.镁离子(Mg2+)核内有12个质子
A.镁离子(Mg2+)核内有12个质子
B.镁的相对原子质量为24.31 g
C.在化学反应中,氯原子容易失去1个电子
D.镁离子(Mg2+)与氯离子(Cl-)的最外层电子数不相等
查看答案和解析>>
科目:初中化学 来源: 题型:
黄铁矿(主要成分为FeS2,杂质不含硫元素)是我国大多数硫酸厂制取硫酸
的主要原料。化学课外活动小组为测定某黄铁矿中FeS2含量进行了如下的实验探究(假设
每步反应均完全)。
 【查阅资料】 ①4FeS2+11O2 2Fe2O3+8SO2
【查阅资料】 ①4FeS2+11O2 2Fe2O3+8SO2
②Na2SO3+H2O2=Na2SO4+H2O
【实验探究】
Ⅰ. 称取1.60 g黄铁矿样品放入下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
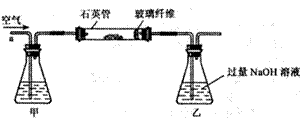
Ⅱ. 反应结束后,将乙瓶中的溶液进行如下处理:
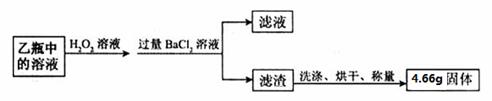
【问题讨论】
(1)Ⅰ中装置中甲瓶内盛放的试剂是氢氧化钠溶液,其作用是 。
【含量测定】
(2)Ⅱ中最终得到的4.66g固体是 (填物质的名称或化学式)。
(3)计算该黄铁矿中FeS2的质量分数。(请写出计算过程)
【交流反思】
(4)如果缺少甲装置,则最终测得FeS2的质量分数将会 (填“偏大”“偏小”或“不变”)。
(5)Ⅱ中证明所加BaCl2溶液过量的方法是 。
【拓展应用】
工业上以黄铁矿为原料生产硫酸的工艺流程图如下所示:
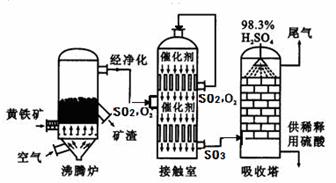
(6)接触室中发生反应的化学方程式为 。化学实验室现有质量分数为9 8%的浓硫酸,但在实验中常需要
8%的浓硫酸,但在实验中常需要 用到较稀的硫酸。要把100g上述浓硫酸稀释成质量
用到较稀的硫酸。要把100g上述浓硫酸稀释成质量 分数为10%的硫酸,需要水的质
分数为10%的硫酸,需要水的质 量是 g。硫酸是一种重要的化工产品,用途十分广泛,请写出稀硫酸的一种用途 。
量是 g。硫酸是一种重要的化工产品,用途十分广泛,请写出稀硫酸的一种用途 。
(7)依据生产硫酸的工艺流程图,下列说法正确的是 (填字母)。
A.为使黄铁矿充分燃烧,需将其粉碎
B.催化剂能够提高SO2的反应速率和产量
C.SO2可做为生产硫酸的原料循环再利用
D.沸腾炉排出的矿渣可供炼铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com