
【题目】现有含碳酸钠的食盐样品,为测定样品中氯化钠的含量,课外活动小组的同学称取10g食盐样品于烧杯中,并将40g稀盐酸平均分成四次加入烧杯中,实验数据见下表:
实验序号 | 加入稀盐 | 反应后烧杯中 |
第一次 | 10 | 19.56 |
第二次 | 10 | 29.12 |
第三次 | 10 | 38.9 |
第四次 | 10 | 48.9 |
(1)求产生CO2气体的总质量。
(2)求样品中氯化钠的纯度。
(3)求使用的稀盐酸的溶质质量分数。
【答案】
(1)解:10g+40g-48.9g=1.1g
答∶产生CO2气体的总质量是1.1g.
(2)解:设10g样品中碳酸钠的质量为X
Na2CO3+ | 2HCl= | 2NaCl+H2O+ | CO2↑ |
106 | 44 | ||
x | 1.1g |
![]() =
=![]()
X=2.65g
所以样品中NaCl的纯度为![]() ×100%=73.5%
×100%=73.5%
答∶样品中NaCl的纯度为73.5%.
(3)解:第一次实验时,生成二氧化碳的质量是10g+10g﹣19.56g=0.44g,
设10g稀盐酸中纯盐酸的质量为y
Na2CO3+ | 2HCl= | 2NaCl+H2O+ | CO2↑ |
73 | 44 | ||
y | 0.44g |
![]() =
=![]()
y=0.73g
所以使用稀盐酸的质量分数为![]() ×100%=7.3%
×100%=7.3%
答∶使用稀盐酸的质量分数为7.3%.
【解析】由质量守恒定律知,(1)求产生CO2气体的总质量∶10g+40g-48.9g=1.1g.
(2)根据第三次反应后的质量与第四次反应的质量之差可以看出,第四次加入的盐酸没有参与反应,所以可得10g样品中的碳酸钠与盐酸能够生成二氧化碳的质量是1.1g;
设10g样品中碳酸钠的质量为X
Na2CO3+ | 2HCl= | 2NaCl+H2O+ | CO2↑ |
106 | 44 | ||
x | 1.1g |
![]() =
= ![]() X=2.65g
X=2.65g
所以样品中NaCl的纯度为![]() ×100%=73.5%
×100%=73.5%
(3)第一次实验时,生成二氧化碳的质量是10g+10g﹣19.56g=0.44g,
设10g稀盐酸中纯盐酸的质量为y
Na2CO3+ | 2HCl= | 2NaCl+H2O+ | CO2↑ |
73 | 44 | ||
y | 0.44g |
![]() =
=![]()
y=0.73g
所以使用稀盐酸的质量分数为![]() ×100%=7.3%
×100%=7.3%
(1)跟据质量守恒定律可知反应前后物质的减少量即为生成的二氧化碳总质量;(2)根据第三次反应后的质量与第四次反应的质量之差可以看出,第四次加入的盐酸没有参与应,所以可得10g样品中的碳酸钠与盐酸能够生成二氧化碳的质量,依据方程式可求出碳酸钠的质量,从而计算出样品中氯化钠的质量分数;(3)可以根据第一次反应时生成的二氧化碳的质量求出反应的盐酸的质量分数;


科目:初中化学 来源: 题型:
【题目】碳化硅(SiC)陶瓷基复合材料是一种新型热结构材料。在空气中碳化硅能与熔融的氢氧化钠发生反应:SiC+2NaOH+2O2 ![]() Na2SiO3+X+H2O,下列有关X物质的化学式推断中,正确的是( )
Na2SiO3+X+H2O,下列有关X物质的化学式推断中,正确的是( )
A.SiO2
B.CO
C.CO2
D.Na2CO3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图中①、②为氧元素、铝元素在元素周期表中的信息示意图,A,B,C,D是四种粒子的结构示意图.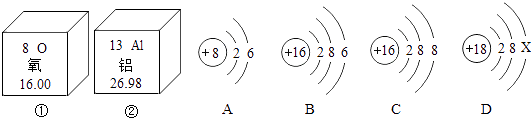
(1)氧元素属于元素(填“金属”或“非金属”);铝元素的质子数是 .
(2)C粒子属于(填“原子”、“阴离子”或“阳离子”);若D为原子,则ⅹ= .
(3)A,B,C,D中属于同种元素的是(填序号).
(4)A粒子的化学性质与B,C,D中哪一种粒子的化学性质相似(填序号).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 打开盛有浓盐酸的瓶盖,在瓶口出现大量白烟
B. 走进公园闻到花香,说明分子在不停地运动
C. 在实验室用稀硫酸和块状大理石制取二氧化碳
D. 家中遇到煤气泄漏,立即开灯检查
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】右图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是( )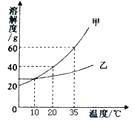
A.甲的溶解度大于乙的溶解度
B.35℃时100g甲的溶液中含甲的质量60g
C.10℃时甲、乙两物质的溶解度相等
D.甲中混有少量乙时可用蒸发结晶的方法提纯甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com