
ΓΨΧβΡΩΓΩΡ≥Ά§―ßΖΔœ÷…œΗω‘¬Ήω Β―ι”ΟΒΡ«β―θΜ·ΡΤ»ή“ΚΆϋΦ«ΝΥΗ«ΤΩΗ«ΓΘΕ‘”ΎΗΟ»ή“Κ «Ζώ±δ÷ Θ§ΗΟΆ§―ßΕ‘¥ΥΫχ––ΝΥΧΫΨΩΓΘ«κΡψ“ΜΤπΆξ≥…œ¬Ν– Β―ι±®ΗφΓΘ
Θ®1Θ©Θ®Χα≥ωΈ Χβ1Θ©ΗΟ»ή“Κ «Ζώ±δ÷ ΘΩ
Θ® Β―ιΧΫΨΩ1Θ©
Β―ι≤Ϋ÷η | Β―ιœ÷œσ | Ϋβ Ά”κΫα¬έ |
»Γ…ΌΝΩΗΟ»ή“ΚΖ≈”Ύ ‘Ιή÷–Θ§ΒΈΦ”ΉψΝΩœΓ―ΈΥα | ”–____≤ζ…ζ | ΥΒΟςΗΟ»ή“Κ“―±δ÷ Θ§±δ÷ ΒΡ‘≠“ρ «_____Θ®«κ”ΟΜ·―ßΖΫ≥Χ Ϋ±μ ΨΘ© |
Θ®2Θ©Θ®Χα≥ωΈ Χβ2Θ©ΗΟ»ή“Κ±δ÷ ≥ΧΕ»‘θ―υΘΩ
Θ®Χα≥ω≤¬œκΘ©≤¬œκ“ΜΘΚ“―Άξ»Ϊ±δ÷ Θ§ΗΟ»ή“Κ÷–»ή÷ ÷ΜΚ§Na2CO3 ≤¬œκΕΰΘΚ≤ΩΖ÷±δ÷ Θ§ΗΟ»ή“Κ÷–»ή÷ Κ§”–_____
Θ®≤ι‘ΡΉ ΝœΘ©¬»Μ·±Β»ή“Κ≥ ÷––‘ΓΘ
Θ® Β―ιΧΫΨΩ2Θ©
Β―ι≤Ϋ÷η | Β―ιœ÷œσ | Ϋα¬έ |
œ»»Γ…ΌΝΩΗΟ»ή“ΚΖ≈”Ύ ‘Ιή÷–Θ§Φ”»κΙΐΝΩ¬»Μ·±Β»ή“Κ | ”–____…ζ≥… | ≤¬œκ____≥…ΝΔ |
Ψ≤÷ΟΘ§»Γ…œ≤ψ«ε“Κ”ΎΝμ“Μ÷ß ‘Ιή÷–Θ§Φ”»κ2-3ΒΈΖ”ΧΣ»ή“Κ | …œ≤ψ«ε“Κ±δΚλ |
Θ®3Θ©Ζ¥ΥΦΘΚ‘ΎΘ® Β―ιΧΫΨΩ2Θ©÷–Φ”»κΙΐΝΩΒΡ¬»Μ·±Β»ή“ΚΒΡΡΩΒΡ « ≤Ο¥ΘΩ___________________ΓΘ
Θ®4Θ©ΆΊ’ΙΘΚ≥ΐ»Ξ≤ΩΖ÷±δ÷ ΒΡ«β―θΜ·ΡΤ»ή“Κ÷–ΒΡ‘”÷ Θ§ΖΫΖ® «___________________Θ®”ΟΜ·―ßΖΫ≥Χ Ϋ±μ ΨΘ©ΓΘ
Θ®5Θ©Χα…ΐΘΚΈΣΫχ“Μ≤ΫΧΫΨΩ«β―θΜ·ΡΤΒΡ±δ÷ ≥ΧΕ»Θ§–ΓΟς≥Τ»Γ 18.6 g «β―θΜ·ΡΤΙΧΧε―υΤΖΖ≈»κ…’±≠÷–Θ§œρΤδ÷–÷πΒΈΦ”»κœΓ―ΈΥαΘ§ΒΫ≤Μ‘Ό≤ζ…ζΤχ≈ίΈΣ÷ΙΘ§Ι≤œϊΚΡœΓ―ΈΥα 100 gΘ§Ζ¥”ΠΚσ≥ΤΒΟ…’±≠÷–»ή“ΚΒΡ÷ ΝΩΈΣ 114.2 gΓΘΗΟ«β―θΜ·ΡΤΒΡ±δ÷ ≥ΧΕ»Θ®Φ¥±δ÷ ΒΡ«β―θΜ·ΡΤ’Φ±δ÷ «ΑΒΡ«β―θΜ·ΡΤΒΡ÷ ΝΩΖ÷ ΐΈΣΘ©__________________ΓΘ
ΓΨ¥πΑΗΓΩΤχ≈ί ![]() NaOHΚΆNa2CO3 ΑΉ…Ϊ≥ΝΒμ Εΰ ≥ΐΨΓ»ή“Κ÷–ΒΡΧΦΥαΡΤΘ§≈≈≥ΐΗ…»≈
NaOHΚΆNa2CO3 ΑΉ…Ϊ≥ΝΒμ Εΰ ≥ΐΨΓ»ή“Κ÷–ΒΡΧΦΥαΡΤΘ§≈≈≥ΐΗ…»≈ ![]() 50%
50%
ΓΨΫβΈωΓΩ
[ Β―ιΧΫΨΩ1]
»γΙϊ«β―θΜ·ΡΤ“―±δ÷ Θ§»ή“Κ÷–ΨΆΜα”–ΧΦΥαΡΤΓΘ»Γ…ΌΝΩΗΟ»ή“ΚΖ≈”Ύ ‘Ιή÷–Θ§ΒΈΦ”ΉψΝΩœΓ―ΈΥαΘ§”–Τχ≈ί≤ζ…ζΘ§―ΈΥα”κΧΦΥαΡΤΖ¥”Π≤ζ…ζΕΰ―θΜ·ΧΦΤχΧεΘ§ΥΒΟς«β―θΜ·ΡΤ“―±δ÷ ΓΘ«β―θΜ·ΡΤ±δ÷ «“ρΈΣ”κΩ’Τχ÷–ΒΡΕΰ―θΜ·ΧΦΖ¥”Π…ζ≥…ΧΦΥαΡΤΚΆΥ°Θ§ΖΫ≥Χ ΫΈΣ![]() ΓΘ
ΓΘ
[Χα≥ω≤¬œκ]
«β―θΜ·ΡΤ»ή“Κ“―Άξ»Ϊ±δ÷ Θ§‘ρ»ή“ΚΒΡ»ή÷ ΨΆΟΜ”–«β―θΜ·ΡΤΘ§÷Μ”–Na2CO3ΘΜ»γΙϊ«β―θΜ·ΡΤ≤ΩΖ÷±δ÷ Θ§‘ρ»ή“Κ÷–»ή÷ Φ»”–«β―θΜ·ΡΤ“≤”–ΧΦΥαΡΤΓΘ
[ Β―ιΧΫΨΩ2]
»γΙϊ“Σ÷ΛΟς±δ÷ ≥ΧΕ»Θ§ΨΆ“Σ÷ΛΟς»ή“Κ÷– «ΖώΚ§”–«β―θΜ·ΡΤΘ§“ρΈΣ«β―θΜ·ΡΤΚΆΧΦΥαΡΤ»ή“ΚΕΦ≥ Φν–‘Θ§Υυ“‘‘Ύ÷ΛΟς«β―θΜ·ΡΤ ±Θ§ Ήœ»“ΣΑ―ΧΦΥαΡΤ≥ΐ»ΞΘ§≈≈≥ΐΗ…»≈ΓΘΖΫΖ® «ΘΚœ»»Γ…ΌΝΩΗΟ»ή“ΚΖ≈”Ύ ‘Ιή÷–Θ§Φ”»κΙΐΝΩ¬»Μ·±Β»ή“ΚΘ§”–ΑΉ…Ϊ≥ΝΒμ≤ζ…ζΘ§“ρΈΣ¬»Μ·±Β”κΧΦΥαΡΤΖ¥”ΠΘ§…ζ≥…ΑΉ…ΪΒΡΧΦΥα±Β≥ΝΒμΓΘΨ≤÷ΟΘ§»Γ…œ≤ψ«ε“Κ”ΎΝμ“Μ÷ß ‘Ιή÷–Θ§Φ”»κ2-3ΒΈΖ”ΧΣ»ή“ΚΘ§…œ≤ψ«ε“Κ±δΚλ…ΪΘ§ΥΒΟς»ή“Κ≥ Φν–‘Θ§‘ρ‘≠»ή“Κ÷–Κ§”–«β―θΜ·ΡΤΘ§“ρ¥Υ≤¬œκΕΰ≥…ΝΔΓΘ
Θ®3Θ©Φ”»κΙΐΝΩΒΡ¬»Μ·±Β»ή“ΚΒΡΡΩΒΡ «Α―ΧΦΥαΡΤ≥ΐ»ΞΘ§“‘ΟβΗ…»≈Φλ―ι«β―θΜ·ΡΤΓΘ
Θ®4Θ©≤ΩΖ÷±δ÷ ΒΡ«β―θΜ·ΡΤ»ή“Κ÷–ΒΡ‘”÷ «ΧΦΥαΡΤΘ§≥ΐ»ΞΧΦΥαΡΤΒΡΖΫΖ® «”Ο ΝΩΒΡ«β―θΜ·ΗΤ”κΧΦΥαΡΤΖ¥”ΠΘ§…ζ≥…«β―θΜ·ΡΤΚΆΧΦΥαΗΤ≥ΝΒμΘ§Ιΐ¬ΥΦ¥Ω…≥ΐ»ΞΝΥΧΦΥαΡΤΒΟΒΫ«β―θΜ·ΡΤ»ή“ΚΘ§Ζ¥”ΠΖΫ≥Χ ΫΈΣΘΚ![]() ΓΘ
ΓΘ
Θ®5Θ©ΗυΨί÷ ΝΩ ΊΚψΕ®¬…Θ§…ζ≥…Εΰ―θΜ·ΧΦΤχΧεΒΡ÷ ΝΩΈΣΘΚ![]() ΓΘ
ΓΘ
…η“―±δ÷ ΒΡ«β―θΜ·ΡΤΒΡ÷ ΝΩΈΣXΘ§±δ÷ …ζ≥…ΧΦΥαΡΤΒΡ÷ ΝΩΈΣYΓΘ
«β―θΜ·ΡΤΈϋ ’Εΰ―θΜ·ΧΦ…ζ≥…ΧΦΥαΡΤΘ§ΧΦΥαΡΤ”κ―ΈΥαΖ¥”Π…ζ≥…Εΰ―θΜ·ΧΦΘ§ΥϋΟ«ΒΡ÷ ΝΩΙΊœΒ «ΘΚ
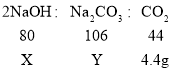
‘ρ«β―θΜ·ΡΤΒΡ±δ÷ ≥ΧΕ»ΈΣΘΚ![]() ΓΘ
ΓΘ


 –¬Χβ–Ά»Ϊ≥ΧΦλ≤βΤΎΡ©≥ε¥Χ100Ζ÷œΒΝ–¥πΑΗ
–¬Χβ–Ά»Ϊ≥ΧΦλ≤βΤΎΡ©≥ε¥Χ100Ζ÷œΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
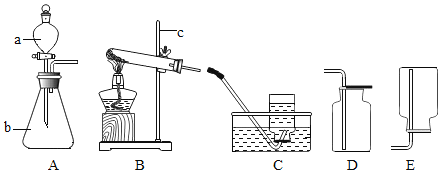
ΓΨΧβΡΩΓΩA©¹G «¥ΩΨΜΈο«“ AΓΔBΓΔCΓΔDΓΔE «≥θ÷–Μ·―ß÷–≥ΘΦϊΒΡ≤ΜΆ§άύ±πΒΡΈο÷ ΓΘΥϋΟ«÷°ΦδΒΡΙΊœΒ»γΆΦΥυ ΨΘ®ΓΑΓζΓ±±μ ΨΈο÷ ΦδΒΡΉΣΜ·ΙΊœΒΘ§ΓΑ©¹Γ±±μ ΨΝΫΕΥΒΡΈο÷ ΡήΖΔ…ζΜ·―ßΖ¥”ΠΘ©ΓΘ A «≤ίΡΨΜ“ΒΡ÷ς“Σ≥…Ζ÷Θ§B «ΙβΚœΉς”Ο≤ΜΩ…»±…ΌΒΡΈο÷ Θ§D «”…ΝΫ÷÷‘ΣΥΊΉι≥…ΒΡΜ·ΚœΈοΘ§E «Ρξ≤ζΝΩΉνΗΏΒΡΫπ τΘ§F «Έ¥ά¥ΉνάμœκΒΡ«εΫύΡή‘¥Θ§«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
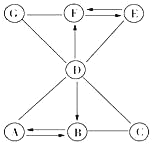
ΔΌ–¥≥ωΜ·―ß ΫΘΚD_____Θ§E_____ΓΘ
ΔΎΈο÷ G Υυ τΒΡΈο÷ άύ±π «_____ΘΜ«κ–¥≥ωΈο÷ G ΚΆΈο÷ F Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ_____Θ®»Έ–¥“ΜΗωΘ©ΓΘ
ΔέΈο÷ C ”κΈο÷ D Ζ¥”ΠΒΡΜυ±Ψάύ–Ά «_____ΓΘ
ΔήΙ≈¥ζ≥ΘΫΪ≤ίΡΨΜ“”κ C »ή“ΚΜλΚœΘ§¬Υ»ΓΖ¥”ΠΚσ«ε“ΚΉςΤ·œ¥ΒΡœ¥Β”ΦΝΓΘ–¥≥ω¥ΥΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ_____ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ¥” ¬ΩΤ―ß Β―ιΒΡ÷Ί“ΣΜΖΫΎ «Ϋχ––ΩΤ―ß Β―ι…ηΦΤΓΘΩΤ―ß Β―ιΒΡ’ΐ»Ζ≤Ϋ÷ηΘΚΔΌΟς»Ζ Β―ιΡΩΒΡΘΜΔΎ ’Φ·”–ΙΊΉ ΝœΘΜΔέ…ηΦΤΚœάμΖΫΑΗΘΜΔήΫχ––ΩΤ―ß Β―ιΓΘ«κΡψΑ¥’’“‘…œΥΡΗω≤Ϋ÷ηΘ§Άξ≥…Φ”»»¬»ΥαΦΊΚΆΕΰ―θΜ·ΟΧΙΧΧεΜλΚœΈο÷Τ»Γ―θΤχΒΡ Β―ι…ηΦΤΓΘΗυΨίœ¬ΆΦΜΊ¥πΈ ΧβΘΚ
«κ–¥≥ω“«ΤςΟϊ≥ΤΘΚa___ b___ c___
Θ® Β―ιΡΩΒΡΘ©Φ”»»¬»ΥαΦΊΚΆΕΰ―θΜ·ΟΧΙΧΧεΜλΚœΈο÷Τ»Γ―θΤχΓΘ
Θ® ’Φ·Ή ΝœΘ© ¬»ΥαΦΊ «ΑΉ…ΪΒΡΙΧΧεΘ§Εΰ―θΜ·ΟΧ «ΚΎ…ΪΙΧΧεΓΘΕΰ―θΜ·ΟΧ‘ΎΖ¥”Π÷–Ής¥ΏΜ·ΦΝΘ§ΜλΚœΦ”»»ΚσΩ…“‘≤ζ…ζ―θΤχΓΘ
Θ®…ηΦΤΖΫΑΗΘ©ΖΔ…ζΉΑ÷Ο―Γ”Ο____________(Χν–ρΚ≈Θ§œ¬Ά§)Θ§ ’Φ·ΉΑ÷Ο―Γ”Ο_____________ΓΘΗΟΜ·―ßΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ________________ΓΘ»γΙϊ Β―ι “”ΟAΉΑ÷Οά¥÷Τ»Γ―θΤχΘ§‘ρΗΟΜ·―ßΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ______________ΓΘ
Θ®Ϋχ–– Β―ιΘ©ΡήΙΜ±Θ÷Λ Β―ι≥…ΙΠ≤Δ ’Φ·ΒΫ“ΜΤΩ±»Ϋœ¥ΩΨΜΒΡ―θΤχΘ§”––μΕύ Β―ιœΗΫΎ–η“ΣΉΔ“βΓΘ«κ»Έ–¥ΝΫΒψΓΘ_______ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
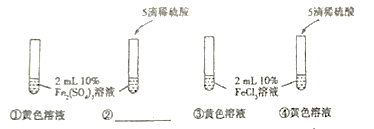
ΓΨΧβΡΩΓΩ”…”ΎΕΰ―θΜ·ΧΦ”κ«β―θΜ·ΡΤ»ή“ΚΖ¥”ΠΈόΟςœ‘œ÷œσΘ§Ε‘¥ΥΆ§―ßΟ«’ΙΩΣΝΥΧΫΨΩΘ§
Θ®Χα≥ωΈ ΧβΘ©Εΰ―θΜ·ΧΦ”κ«β―θΜ·ΡΤ»ή“ΚΡήΖώΖΔ…ζΖ¥”ΠΘΩ
Θ®≤ι‘ΡΉ ΝœΘ©ΔΌ“―÷ΣΧΦΥα«βΡΤ»ή“Κ≤Μ”κΕΰ―θΜ·ΧΦΖ¥”ΠΓΘ
ΔΎ≥ΘΈ¬œ¬Θ§«β―θΜ·ΡΤΓΔΧΦΥαΡΤ‘Ύ““¥Φ÷–ΒΡ»ήΫβ–‘»γœ¬ΓΘ
»ήΦΝ | ““¥Φ | |
»ή÷ | «β―θΜ·ΡΤ | ΧΦΥαΡΤ |
»ήΫβ–‘ | “Ή»ή | Ρ―»ή |
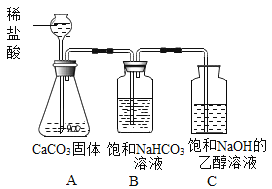
Θ®ΖΫΑΗ…ηΦΤΘ©–ΓΟςΆ§―ß…ηΦΤΝΥ»γΆΦΥυ ΨΉΑ÷ΟΫχ––ΧΫΨΩΓΘ
Θ® Β―ιΧΫΨΩΘ©
(1)»ή“Κ≈δ÷ΤΓΘC÷–±ΞΚΆ»ή“ΚΘΚΫΪ“ΜΕ®÷ ΝΩΒΡ«β―θΜ·ΡΤΙΧΧεΦ”»κΒΫ“ΜΕ®ΧεΜΐΒΡ““¥Φ÷–Θ§”Ο≤ΘΝßΑτ≤ΜΕœΫΝΑηΘ§ ΙΤδ≥…ΈΣ±ΞΚΆ«β―θΜ·ΡΤΒΡ““¥Φ»ή“ΚΓΘ≤ΘΝßΑτΒΡΉς”Ο «____ΓΘ≈–ΕœC÷–±ΞΚΆ»ή“Κ–Έ≥…ΒΡœ÷œσ «____ΓΘ
(2)Ϋχ–– Β―ιΘ§Α¥ΆΦΥυ ΨΉΑ÷ΟΦ”»κ“©ΤΖΚσΫχ–– Β―ιΓΘBΉΑ÷ΟΒΡΉς”Ο «____Θ§C÷–Ιέ≤λΒΫΒΡœ÷œσ «____ΓΘ
Θ® Β―ιΫα¬έΘ©
(3)”…¥Υ–ΓΟςΒΟ≥ωΕΰ―θΜ·ΧΦ”κ«β―θΜ·ΡΤΖΔ…ζΝΥΜ·―ßΖ¥”ΠΘ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ____ΓΘ
Θ®Ζ¥ΥΦΫΜΝςΘ©
(4)–ΓΗ’Ά§―ß»œΈΣ–ΓΟςΒΡ Β―ιΜΙ≤ΜΉψ“‘÷ΛΟςΕΰ―θΜ·ΧΦ”κ«β―θΜ·ΡΤΖΔ…ζΝΥΜ·―ßΖ¥”ΠΘ§ΜΙ”Π≤Ι≥δΒΡ Β―ι «____ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΫϋΤΎΘ§―κ ”Ε‘‘ΎΆχ¬γ…œΝς¥ΪΉ≈ΒΡ“Ξ―‘ΓΣΥήΝœΉω≥…ΓΑ¥σΟΉΓ±Ϋχ––±Ό“ΞΓΘ Ή Νœ±μΟςΘΚΫΪ¥σΟΉΚΆΓΑΥήΝœ¥σΟΉΓ±Ζ÷±π‘Ύ’τΖΔΟσ÷–Φ”»»Θ§¥σΟΉ±δΜΤΓΔ±δΫΙΓΔ”–ΟΉœψΈΕΘ§ΕχΓΑΥήΝœ¥σΟΉΓ±Φ”»»Κσ±δ≥…’≥≥μΒΡ“ΚΧεΓΘ
Θ®1Θ©ΥήΝœΒΡΜΊ ’‘Όάϊ”Ο“β“ε÷Ί¥σΓΘœ¬Ν– τ”ΎΜΊ ’±ξ÷ΨΒΡ «____________Θ®Χν±ξΚ≈Θ©ΓΘ
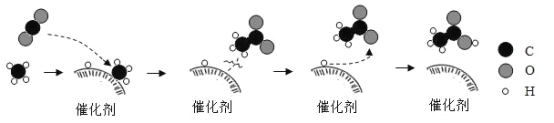
Θ®2Θ©ΖΌ…’ΜΊ ’ΒΡ±Θœ ΡΛΘ§…ζ≥…ΒΡ CO2 Ω…”Οά¥…ζ≤ζΜ·ΙΛ≤ζΤΖ““ΥαΘ®CH3COOHΘ©Θ§ΉΣΜ·ΒΡΈΔΙέΙΐ≥Χ»γΆΦΥυ ΨΓΘΗΟΖ¥”ΠΙΐ≥Χ÷–Θ§±Θ≥÷≤Μ±δΒΡΈΔΝΘ «______________Θ®ΧνΓΑΖ÷Ή”Γ±ΜρΓΑ‘≠Ή”Γ±Θ©Θ§Ζ¥”ΠΈο CO2”κ≤ζΈοCH3COOHΒΡΖ÷Ή”Ηω ΐ±»ΈΣ______________ΓΘ
Θ®3Θ©ΟωΦ°ΩΤ―ßΦ“’≈άΰΡ»ΖΔΟςΝΥ“Μ÷÷ΓΑ…ώΤφ»ήΦΝΓ±ΓΘΗΟΓΑ…ώΤφ»ήΦΝΓ± «”…«β―θΜ·ΡΤΓΔΡρΥΊΚΆΥ°ΒΡ÷ ΝΩ±»Α¥ 7ΘΚ12ΘΚ81 ≈δ÷ΤΕχ≥…ΓΘ
ΔΌάϊ”ΟΗΟΓΑ…ώΤφ»ήΦΝΓ±»ήΫβ≈©“ΒΖœΤζΈο…ζ≤ζΒΡ–¬–ΆœΥΈ§ΥΊΡΛΘ§‘ΎΆΝ»ά÷–ΡήΆξ»ΪΫΒΫβΓΘάϊ”Ο¥ΥΡΛΧφ¥ζΤ’Ά®ΥήΝœΘ§Ω…ΜΚΫβΒΡΜΖΨ≥Έ Χβ «____________________________Θ®–¥“ΜΒψΘ©ΓΘ
ΔΎΓΑ…ώΤφ»ήΦΝΓ± «“Μ÷÷»ή“ΚΘ§Τδ»ή÷ ”–________________________________________ΓΘ
ΔέΡ≥¥Έ…ζ≤ζ–η”ΟΒΫ100kgΓΑ…ώΤφ»ήΦΝΓ±Θ§ «”Ο«β―θΜ·ΡΤ»ή“ΚΚΆΡρΥΊά¥≈δ÷ΤΘ§Υυ”ΟΒΡ«β―θΜ·ΡΤ»ή“ΚΒΡ»ή÷ ÷ ΝΩΖ÷ ΐΈΣ___________________________Θ®Ν–≥ωΦΤΥψ ΫΦ¥Ω…Θ©ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»γΆΦ «AΓΔBΓΔc»ΐ÷÷ΙΧΧεΈο÷ ΒΡ»ήΫβΕ»«ζœΏΘ§œ¬Ν–ΥΒΖ®÷–’ΐ»ΖΒΡ «Θ®_____Θ©
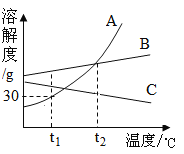
A.![]() Γφ ±Θ§65gAΒΡ±ΞΚΆ»ή“Κ÷–Κ§”–50g»ήΦΝ
Γφ ±Θ§65gAΒΡ±ΞΚΆ»ή“Κ÷–Κ§”–50g»ήΦΝ
B.‘Ύ![]() ΓφΘ§AΓΔBΝΫ÷÷Έο÷ ΒΡ»ή“Κ»ή÷ ÷ ΝΩΖ÷ ΐœύΆ§
ΓφΘ§AΓΔBΝΫ÷÷Έο÷ ΒΡ»ή“Κ»ή÷ ÷ ΝΩΖ÷ ΐœύΆ§
C.ΫΪ![]() ΓφAΓΔBΓΔC»ΐ÷÷Έο÷ ΒΡ±ΞΚΆ»ή“Κ…ΐΈ¬÷Ν
ΓφAΓΔBΓΔC»ΐ÷÷Έο÷ ΒΡ±ΞΚΆ»ή“Κ…ΐΈ¬÷Ν![]() Γφ ±Θ§»ή“Κ÷–»ή÷ ÷ ΝΩΖ÷ ΐ”…–ΓΒΫ¥σΒΡΥ≥–ρΈΣC<B=A
Γφ ±Θ§»ή“Κ÷–»ή÷ ÷ ΝΩΖ÷ ΐ”…–ΓΒΫ¥σΒΡΥ≥–ρΈΣC<B=A
D.Β±A÷–Κ§”–…ΌΝΩB ±Θ§Χα¥ΩAΒΡΖΫΖ® «____________
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΜ·―ß–ΓΉιΆ§―ßΫ≤…ζ–βΒΡΧζΕΛΖ÷±πΖ≈»κœΓ―ΈΥαΚΆœΓΝρΥα÷–Φ”»»Θ§ΖΔœ÷œΓ―ΈΥα≥ΐΧζ–βΚσ»ή“Κ±δΈΣΜΤ…ΪΘ§ΕχœΓΝρΥα≥ΐΧζ–βΚσ»ή“Κ»‘ΈΣΈό…ΪΓΘ’βΦΛΖΔΝΥΥϊΟ«ΒΡΧΫΨΩ–Υ»ΛΘ§«κΡψΙ≤Ά§Άξ≥…ΓΘ
–¥≥ωœΓ―ΈΥα≥ΐΧζ–βΒΡΜ·―ßΖΫ≥Χ Ϋ:_______________________ΓΘ
[Χα≥ωΈ Χβ]ΈΣ ≤Ο¥¬»Μ·Χζ»ή“Κ≥ ΜΤ…ΪΕχΝρΥαΧζ»ή“ΚΈό…ΪΘΩ
[≤ι‘ΡΉ Νœ]![]() ΒΡΥ°»ή“Κ≥ ΜΤ…ΪΘ§”ωΥαΜαΆ …ΪΓΘ
ΒΡΥ°»ή“Κ≥ ΜΤ…ΪΘ§”ωΥαΜαΆ …ΪΓΘ
[≤¬œκ”κΦΌ…η]ΗυΨί≤ι‘ΡΉ ΝœΘ§Ά§―ßΟ«“Μ÷¬»œΈΣΝρΥαΧζ»ή“ΚΚ§”–![]() Θ§»ή“Κ”ΠΗΟ «ΜΤ…ΪΘ§Τδ≥ œ÷Έό…ΪΒΡ‘≠“ρΩ…Ρή «____________ΓΘ
Θ§»ή“Κ”ΠΗΟ «ΜΤ…ΪΘ§Τδ≥ œ÷Έό…ΪΒΡ‘≠“ρΩ…Ρή «____________ΓΘ
[Ϋχ–– Β―ι]
[œ÷œσ”κΫα¬έ]Θ®1Θ©ΔΎ÷– «_________»ή“ΚΘ§‘ρ≤¬œκ’ΐ»ΖΓΘ
Θ®2Θ©ΗυΨί Β―ιΘ§Ε‘±»ΔΎΔή÷–ΒΡ»ή“Κ―’…ΪΘ§Ά§―ßΟ«»œΈΣ¬»Μ·Χζ»ή“ΚΈΣΜΤ…ΪΘ§Ω…Ρή «___________ΓΘ
Θ®3Θ©«κΡψ‘Ό…ηΦΤ“ΜΗω Β―ι÷ΛΟς¬»Μ·Χζ»ή“Κ≥ ΜΤ…ΪΒΡ‘≠“ρΓΘ Β―ιΖΫΑΗ:»Γ ‘ΙήΔΌ÷–ΒΡ»ή“ΚΘ§_______________
Θ®«κΟη ω±Ί“ΣΒΡ Β―ι≤ΌΉςΚΆœ÷œσΘ©ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœΓΝρΥαΩ…“‘ΚΆΧζΖ¥”ΠΒΟΒΫ¥σΝΩΒΡ«βΤχΘ§≈®ΝρΥụ≤ΜΡήΘ§œΓΝρΥα≤Μ”κΧΦΒΞ÷ Ζ¥”ΠΘ§≈®ΝρΥαΦ”»» ±»¥Ω…“‘ΚΆΧΦΒΞ÷ Ζ¥”Π…ζ≥…Υ°ΚΆΝμΆβΝΫ÷÷+4Φέ‘ΣΥΊ―θΜ·ΈοΓΘ
(1)”…¥ΥΈ“Ο«Ω…“‘»œ ΕΒΫΈο÷ ΒΡ–‘÷ ”κΤδ_____Οή«–œύΙΊΓΘ
(2)≈®ΝρΥαΦ”»» ±ΚΆΧΦΒΞ÷ Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ______ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΤϊ≥ΒΑ≤»ΪΤχΡ“÷–≥ΘΚ§”–NaHCO3ΓΔFe2O3ΓΔNaN3ΓΔKClO4Β»Έο÷ Θ§Β±ΖΔ…ζ≈ωΉ≤ ±Θ§ΥϋΟ«ΝΔΦ¥Ζ¥”Π≤ζ…ζ¥σΝΩΤχΧεΘ§ ΙΤχΡ“―ΗΥΌ≈ρ’ΆΕχΤπΒΫ±ΘΜΛΉς”ΟΓΘ
Θ®1Θ©NaHCO3ΥΉ≥Τ_____Θ§”…NaΘΪΚΆ_____Θ®ΧνάκΉ”ΖϊΚ≈Θ©ΙΙ≥…ΘΜKClO4÷–Cl‘ΣΥΊΒΡΜ·ΚœΦέΈΣ_____ΓΘ
Θ®2Θ©‘Ύ“©ΦΝ‘β ήΉ≤Μς ±Θ§NaN3 Ήœ»Ζ÷ΫβΈΣΫπ τ Na ΚΆ“Μ÷÷≥ΘΦϊΒΡΤχΧεΒΞ÷ Θ§ΗΟΤχΧεΒΡΜ·―ß ΫΈΣ_____ΓΘ
Θ®3Θ©KClO4»ή“Κ «“Μ÷÷≥Θ”ΟΒΡΜ·―ßΖ÷Έω ‘ΦΝΓΘœ÷”ϊ≈δ÷Τ100g÷ ΝΩΖ÷ ΐΈΣ10%ΒΡKClO4»ή“ΚΘ§Ιΐ≥Χ»γœ¬ΆΦΥυ ΨΘΚ
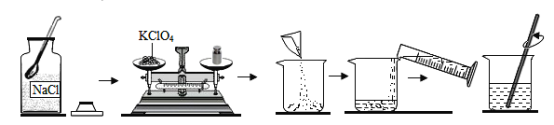
Β―ιΙΐ≥Χ÷––η≥ΤΝΩ_____gKClO4ΙΧΧεΘ§ Ι”ΟΒΡ“«Τς÷ς“Σ”–_____ΓΔΆ–≈ΧΧλΤΫΓΔ…’±≠ΓΔ≤ΘΝßΑτΓΔ“©≥ΉΒ»ΓΘ
Θ®4Θ©NaHCO3 ή»» ±…ζ≥…CO2ΓΔH2OΚΆ¥ΩΦνΓΘ«κ–¥≥ωΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ_____ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com