
【题目】向200gAgNO3溶液中加入m克Fe和Cu的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得21.6g固体。向滤液中滴加NaCl溶液,产生白色沉淀。下列说法正确的是( )
A.滤液的质量是178.4g
B.混合粉末的质量范围是5.6g<m<6.4g
C.固体中加入稀盐酸可能会有气体生成
D.原AgNO3溶液的溶质质量分数是17%
【答案】B
【解析】
加入氯化钠溶液后,产生白色沉淀,说明溶液中硝酸银有剩余,铁和铜全部被消耗完毕,而铁的金属活动性强于铜,所以是铁先与硝酸银反应,然后铜再与硝酸银反应。
A、根据分析可知,生成的固体全部为银,所以反应前质量为200g+mg,反应后质量=滤液质量+固体银的质量,所以滤液质量=200g+mg-固体银的质量=200g+mg-21.6g=178.4g+mg,所以滤液质量大于178.4g,选项A错误;
B、假设混合粉末中全是铁,则铁的质量为x,
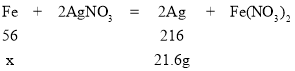
![]() ,x=5.6g
,x=5.6g
若混合物全是铜,则铜的质量为y,
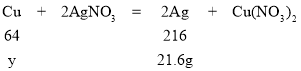
![]() ,y=6.4g
,y=6.4g
而混合物为铁和铜的混合物,所以其质量介于x与y之间,即5.6g<m<6.4g,选项B正确;
C、根据分析可知,铁被全部反应完毕,剩余的固体为生成的银,银金属活动性弱于氢,所以不会与酸反应生成氢气,选项C错误;
D、反应中铜和铁被全部消耗完毕,与硝酸银反应生成了银单质,而加入氯化钠之后,还有白色沉淀生成,说明还有硝酸银未反应,而先按生成21.6g银计算,根据银质量守恒,设硝酸银质量为a,a×![]() ,a=34g,溶质质量分数=
,a=34g,溶质质量分数=![]() ,而硝酸银还有剩余,所以含有硝酸银的质量大于34g,因此硝酸银溶液中溶质质量分数大于17%,选项D错误。故选B。
,而硝酸银还有剩余,所以含有硝酸银的质量大于34g,因此硝酸银溶液中溶质质量分数大于17%,选项D错误。故选B。


科目:初中化学 来源: 题型:
【题目】人类历史发展的不同阶段曾以不同金属材料的使用作为标志。

(1)金、银在自然界有单质形式存在,说明它们的化学性质_____;
(2)在生产生活实践中,人类逐渐掌握了多种金属的冶炼技术。
①比较两种铁矿石:磁铁矿(主要成分 Fe3O4)和菱铁矿(主要成分 FeCO3),从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是______;
②铝制品应用广泛,不易被腐蚀,是因为______(用化学方程式来表示);
(3)镁铝合金被誉为“21 世纪绿色金属结构材料”。一种镁铝合金 Mg17All2 是特殊的储氢材料,完全吸收氢气后得到 MgH2 和 Al,该反应的化学方程式为_____;
(4)钛和钛合金是 21 世纪的重要的金属材料。钛合金制品放在海水中数年,取出后仍光亮如新,是因为其_____(填字母序号)非常好;
A 可塑性 B 机械性能 C 抗腐蚀性能
(5)铁在潮湿的空气中易生成疏松的铁锈。已知:2FeCl3+Fe=3FeCl2
①铁锈的主要成分是________(填化学式),将生锈的铁制品放入一定量的稀盐酸中充分反应,变化过程中最多涉及______种化学反应基本类型;
②将 10g 表面生锈的铁钉(杂质已忽略)浸泡在 100g 溶质质量分数为 7.3%的稀盐酸中充分反应,观察到铁锈已完全消失。反应停止后,取出光亮的铁钉洗涤、干燥、称量,质量为 3.6g。则原生锈铁钉中铁元素的质量分数为______;
(6)利用“活泼金属”可以制得 H2 用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有________ (填字母序号)。
A 金属原料的成本 B 生成过程中的能耗和污染 C 金属的回收利用
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】加热氯酸钾和二氧化锰的混合物可以制备氧气,该反应的化学方程式为______________。
但实验中发现有刺激性气味的气体生成。请你一起参与探究:
(提出问题)刺激性气味的气体是什么呢?
(猜想假设)
猜想一:臭氧(化学式为O3)。
猜想二:HCl。
猜想三:Cl2。
同学们认为不需要验证就可以判断___________是错误的,理由是______________。
(链接资料)
(1)![]() ,HClO 在水溶液中可解离出少量 H+、Cl-、ClO-、HClO 具有强氧化性和漂白性,可杀灭细菌、病毒,使有色物质褪色;
,HClO 在水溶液中可解离出少量 H+、Cl-、ClO-、HClO 具有强氧化性和漂白性,可杀灭细菌、病毒,使有色物质褪色;![]() ,AgCl 是一种白色沉淀。
,AgCl 是一种白色沉淀。
(2)臭氧在二氧化锰存在的情况下极易分解产生氧气。
(实验探究)
查阅资料后大家认为猜想一是错误的,理由为______________。他们进一步做了如下实验:取氯酸钾和二氧化锰的混合物放入试管中加热,将蘸有硝酸银溶液的玻璃棒伸入试管口,看到的现象是___________,再将湿润的蓝色石蕊试纸悬于试管口,试纸______________,最终证明猜想三正确。
(反思拓展)
自来水厂常用漂白粉杀菌消毒主要成分的化学式为Ca(ClO)2,在水中起杀菌消毒作用的离子是_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用甲和乙通过化合反应制备丙,如图是三种分子的模型图,根据微观示意图得出的结论错误的是( )
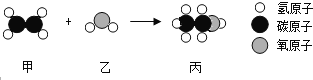
A. 甲的化学式为C2H4
B. 保持乙化学性质的最小微粒是水分子
C. 乙和丙都属于氧化物
D. 化学反应前后分子的种类都发生了改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向氢氧化钠溶液中通入二氧化碳,反应的化学方程式为________,实验没有明显现象,若要证明两者发生了化学反应,你采取的实验方法是_______。
(1)但某同学在常温下向饱和的氢氧化钠溶液中通入二氧化碳时,发现溶液中出现了白色沉淀。同学们对此现象产生了浓厚的兴趣,准备对产生此现象的原因进行探究。
(查阅资料)①常温下部分物质的溶解度
物质名称 | 氢氧化钠 | 碳酸钠 | 碳酸氢钠 |
溶解度(单位:g) | 109 | 21.5 | 9.6 |
②在碳酸钠溶液中不断通入二氧化碳可发生如下反应:Na2CO3+CO2+H2O=2NaHCO3
③碳酸氢钠溶液显碱性。
(提出问题)产生的白色沉淀是什么?
(提出猜想1)猜想①:可能是碳酸钠;猜想②:可能是碳酸氢钠;猜想③:可能是________
(设计实验1)小明向白色沉淀中加入大量水溶解得到溶液。向溶液中加入过量氯化钡溶液,观察到_____,过滤,向滤液中加入________,观察到溶液变为红色,得出结论猜想③成立。
(进一步探究)在氢氧化钠溶液中通入二氧化碳产生沉淀物与什么因素有关?
(提出猜想2)猜想①:可能与氢氧化钠溶液的浓度有关;猜想②:可能与通入的CO2气体量的多少有关。
(设计实验2)
(2)请帮助小明设计实验验证猜想①是否成立。
你的实验方案是:________
实验现象:________
实验结论:与NaOH溶液的浓度有关。
(3)进一步实验发现与通入的CO2气体量的多少也有关,最终得出猜想②也成立。
(拓展提升)向饱和的碳酸钠溶液中通入CO2气体,也有白色沉淀生成。
(4)分析生成沉淀的原因______,根据实验结论,写出一种鉴别饱和碳酸钠和碳酸氢钠溶液的方法____
(5)实验发现常温下,在一定溶质质量分数的碳酸钠溶液中通入足量的二氧化碳就能出现沉淀现象,该碳酸钠溶液的溶质质量分数应高于______(计算结果精确到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人们的衣、食、住、行中包含着许多的化学知识。
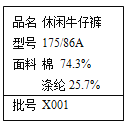
(1)某服装标签如图,该服装面料含有的合成纤维是_____,生活中常用来鉴别棉纱和羊毛的方法是_____。
(2)为了身体健康,我们每天食用很多蔬菜和水果,其中富含的营养素是_____。
(3)新装修的房屋经常能闻到装修材料中释放出的刺激性气味,人们能闻到这种气味的原因是_____。
(4)低碳出行是为了减少_____(填化学式)的排放,在物质分类中它属于_____(填“单质”或“化合物”);自行车是很多人出行的工具,下雨天骑自行车后如果不及时保养,链条经常会生锈,铁锈的主要成分是氧化铁,化学式为_____,请写出一条防止自行车链条生锈的措施_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两物质的溶解度曲线如图所示。下列叙述中,正确的是( )
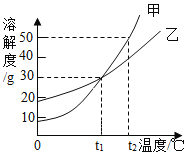
A. t1℃时,甲和乙溶解度均为30g
B. t2℃时,甲和乙的饱和溶液中溶质质量分数相等
C. t2℃时,在100g水中放入60g甲,其溶质的质量分数为37.5%
D. t2℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】联合国将 2019 年列为“国际化学元素周期表年”。锶、镁元素在元素周期表中的部分信息及原子结构示意图如下,下面说法正确的是( )
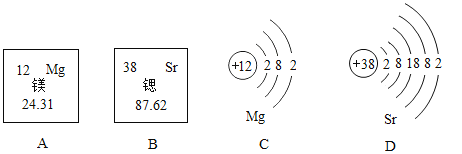
A.这两种元素的化学性质差异很大B.锶原子的中子数为38
C.锶的氧化物化学式为SrOD.镁的相对原子质量为24.31g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】探究实验发现规律
(1)探究影响物质溶解性的因素.
实验一 | 实验二 |
|
|
实验一目的是探究__________对硝酸钾溶解性的影响; 实验二观察到的实验现象为氯化钠溶解于水,不能溶解于酒精中。该实验的目的是探究__________对氯化钠溶解性的影响.
(2)运用溶解度曲线信息回答下列问题:甲、乙、丙三种物质(均不含结晶水)的如图所示,

①20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为__________。
②在__________时,甲和乙两物质的溶解度相等。若丙中混有少量甲,可将其溶液__________结晶,趁 热过滤以提纯丙。
③50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至 10℃,所得溶液中溶质质量分数最小的是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com