
| A. | 该铕原子的质子数为63 | B. | 该铕原子的中子数为63 | ||
| C. | 该铕原子的核外电子数为90 | D. | 该铕原子的质量为153g |
分析 A、根据在原子中质子数=核电荷数=核外电子数判断;
B、根据相对原子质量≈质子数+中子数计算;
C、根据在原子中质子数=核电荷数=核外电子数判断;
D、根据原子质量与相对原子质量的区别判断.
解答 解:A、原子一般是由质子、中子、电子构成的,其中中子不带电,一个质子带一个单位的正电荷,一个电子带一个单位的负电荷,原子对外不显电性,所以在原子中质子数=核电荷数=核外电子数,铕元素的核电荷数为63,其质子数和电子数也为63,故A正确;
B、根据相对原子质量≈质子数+中子数,铕元素原子的中子数为153-63=90,故B错误;
C、在原子中质子数=核电荷数=核外电子数,铕元素的核电荷数为63,其质子数和电子数也为63,故C错误;
D、铕元素原子的质量是指实际质量,其单位一般是克,在该题中无法判断.故D错误.
故选:A.
点评 了解原子的定义和构成:原子由原子核和核外电子构成,其中原子核由质子和中子构成的;熟记规律“原子序数=核内质子数=核外电子数=核电荷数”.


科目:初中化学 来源: 题型:选择题
 如图为锶元素原子结构示意图和在元素周期表中的部分信息,下列说法正确的是( )
如图为锶元素原子结构示意图和在元素周期表中的部分信息,下列说法正确的是( )| A. | 锶原子的核外电子数为2 | B. | 硫酸锶的化学式为SrSO4 | ||
| C. | 锶离子比锶原子多2个电子 | D. | 锶的相对原子质量为38 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
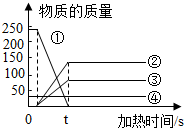
| A. | 反应结束时①的质量一定等于②和③的质量之和 | |
| B. | ②和③一定是反应物 | |
| C. | ④可能是反应物也可能是生成物 | |
| D. | 该反应属于分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
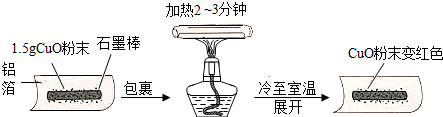
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

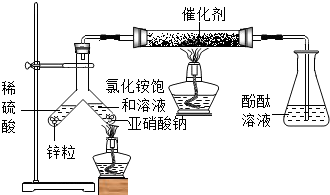
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com