
分析 (1)根据二氧化锰是过氧化氢分解的催化剂,反应前后质量不变.
(2)根据化合物中元素的质量分数的计算公式可以计算出锰元素的质量分数;
(3)利用分解过氧化氢制氧气的化学方程式,根据氧气的物质的量求出过氧化氢的质量,根据溶质的质量分数计算公式求出过氧化氢溶液中溶质的质量分数.
解答 解:(1)反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量就是二氧化锰的质量,是2.5g;
(2)二氧化锰中锰元素的质量分数为:$\frac{55}{55+16×2}$×100%=63.2%
生成氧气的质量为:0.1mol×32g/mol=3.2g
设:该过氧化氢溶液中溶质的质量为x
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 32
x 3.2g
$\frac{68}{x}$=$\frac{32}{3.2g}$
解得:x=6.8g
原过氧化氢溶液溶质的质量分数为:$\frac{6.8g}{100g}$×100%=6.8%
答:原过氧化氢溶液溶质的质量分数6.8%.
故答案为:(1)2.5g;
(2)63.2%;
(3)6.8%.
点评 本题考查了根据化学方程式的计算,完成此题,可以依据题干提供的信息结合反应的化学方程式进行.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 t2℃时,向盛有10mL水的A、B两试管中分别加入等质量的甲、乙两种可溶性固体,使其充分溶解后,观察到如图一所示的现象,请回答:
t2℃时,向盛有10mL水的A、B两试管中分别加入等质量的甲、乙两种可溶性固体,使其充分溶解后,观察到如图一所示的现象,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 控制变量法是常用的化学学习方法.下面是探究燃烧条件的实验,请你根据图示信息和资料信息回答有关问题.
控制变量法是常用的化学学习方法.下面是探究燃烧条件的实验,请你根据图示信息和资料信息回答有关问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
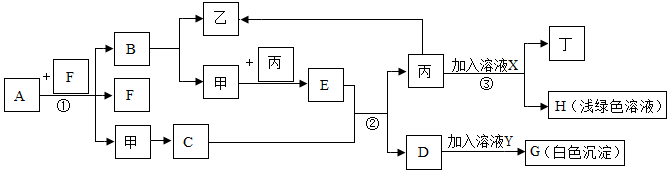
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com