
 %,溶质为氯化钠,包括原混合物中的氯化钠(用混合物的质量-氯化钙的质量即可求出)和反应生成的氯化钠(根据碳酸钠的质量可求出),反应后所得溶液的质量=所加入的所有物质的质量总和-生成沉淀的质量.
%,溶质为氯化钠,包括原混合物中的氯化钠(用混合物的质量-氯化钙的质量即可求出)和反应生成的氯化钠(根据碳酸钠的质量可求出),反应后所得溶液的质量=所加入的所有物质的质量总和-生成沉淀的质量.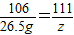

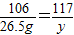
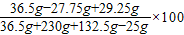 %=10.2%
%=10.2%

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2011?南通模拟)氯化钙、氯化钠和碳酸钠都是生产生活离不开的化工原料.
(2011?南通模拟)氯化钙、氯化钠和碳酸钠都是生产生活离不开的化工原料.查看答案和解析>>
科目:初中化学 来源: 题型:
在某温度下,将36.5gCaCl2和NaCl的混合物放入236g水中使其完全溶解,再加入132.5g溶质质量分数为20%的Na2CO3溶液,恰好完全反应。(CaCl2+Na2CO3= CaCO3↓+2NaCl)
试计算:(1)生成CaCO3沉淀的质量是多少g? (计算结果保留一位小数)
(2)反应后所得溶液的溶质质量分数是多少g?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com