
| 相对原子质量×原子个数 |
| 相对分子质量 |
| 14×2 |
| 132 |
| 14×2 |
| 132 |
| 14×2 |
| 14×2+1×4+16×3 |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:初中化学 来源: 题型:
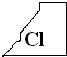 实验室有一瓶试剂的标签破损不清如图,甲乙丙三位同学对它的主要成分进行讨论,一起猜想:甲同学认为,该试剂主要成分是酸;乙同学认为,白色固体可能是碱;丙同学认为,该试剂主要成分是盐.
实验室有一瓶试剂的标签破损不清如图,甲乙丙三位同学对它的主要成分进行讨论,一起猜想:甲同学认为,该试剂主要成分是酸;乙同学认为,白色固体可能是碱;丙同学认为,该试剂主要成分是盐.查看答案和解析>>
科目:初中化学 来源: 题型:
| 序号 | 第1次 | 第2次 | 第3次 | 第4次 |
| 加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 11 | 6 | 2.8 | 2.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 如图是某同学设计的探究铁锈蚀条件的装置,实验开始前,调节L端与R端的液面高度一致,塞紧木塞进行实验,请回答下列问题:
如图是某同学设计的探究铁锈蚀条件的装置,实验开始前,调节L端与R端的液面高度一致,塞紧木塞进行实验,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
 如图是雪碧汽水标签中的部分内容.
如图是雪碧汽水标签中的部分内容.查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com