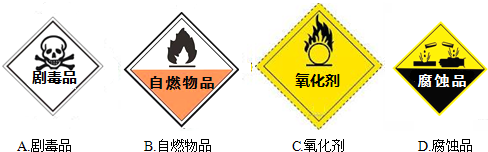
解:(1)过氧化氢溶液俗称“双氧水”,是常用的氧化剂;图C为氧化剂药品的标识;
故答案为:C;
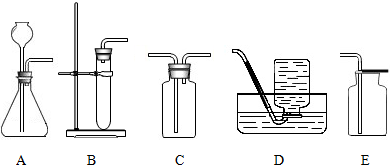
(2)①收集干燥的氧气,可把气体能过装置浓硫酸的装置C后,使用向上排空气法对气体进行收集;
故答案为:ACE或BCE;
②过氧化氢溶液缓缓加入,反应速率可以保持相对稳定,而得到平稳的气流;也可以通过过氧化氢溶液缓缓加入达到控制反应的目的;
故答案为:能获得平稳的氧气流(或便于控制产生气体的速率,控制反应进程,或防止反应过快);
③反应中的催化剂二氧化锰在反应前后质量和化学性质均不变,仍可催化过氧化氢的分解;
故答案为:MnO
2是催化剂(或MnO
2起催化作用或没有消耗)[或MnO
2在化学反应前后质量和化学性质都没有改变];
④反应溶液中的水中溶解有一定量的反应生成的氧气,致使收集气体比理论值偏小;为收集到较为纯净的氧气,待产生的气体均匀连续冒出时才开始收集,因此有部分气体没有收集;等等;
故答案为:液体中溶有一定量的气体(或在等气体较纯净收集前散逸一定量的气体,或有部分气体滞留在装置中没有排出,或排水法收集气体结束时先将导管移出水面再停止产生气体时有一定量的气体散逸,或在制气前H
2O
2有部分已分解,或收集不完全)(说明过程中“气体的损耗”即可);
(3)根据反应的化学方程式为X+8H
2O
2=2CO
2↑+N
2↑+12H
2O,生成物的2个CO
2分子、1个N
2分子和12个H
2O分子中共含C、H、O、N原子的个数依次为2、24、16、2;而反应前的8个H
2O
2分子中只含有16个H原子和16个O原子;根据化学变化前后原子种类、数目不变,则偏二甲肼X的分子中含有2个C原子、8个H原子和2个N原子,其化学式可表示感谢为C
2H
8N
2;
故答案为:C
2H
8N
2;
(4)设过氧化氢的质量为x
2H
2O
2
2H
2O+O
2↑
68 32
x wg

=

x=

wg
过氧化氢溶液中溶质的质量分数=
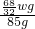
×100%=

×100%=2.5w%
故答案为:2.5%w[或2.5w%、

、0.025w、

×100%].
分析:(1)过氧化氢溶液俗称“双氧水”,具有强氧化性,是一种氧化剂;
(2)①收集干燥的氧气,不能使用排水法收集,为除去混在气体中的水,需要使用干燥剂对气体进行干燥处理;
②过氧化氢溶液缓缓加入可以控制药品用量,达到控制反应速率的目的,使产生的气流平稳;
③反应中的二氧化锰是反应的催化剂,在反应前后其质量和化学性质不变,仍可以继续使用;
④氧气溶于水、或氧气没有完全排出还有部分残留于反应容器中、或排出的氧气并没进行完全收集等原因都会造成所收集到的氧气量小于理论计算值;
(3)利用反应的化学方程式,根据化学变化前后原子种类、数目不变,推导出偏二甲肼的分子构成,写出其化学式;
(4)完全反应前后质量均为85g,说明放出的氧气的质量与所加入的催化剂二氧化锰质量相等;根据反应的化学方程式,由氧气质量计算出完全反应时分解的过氧化氢的质量,过氧化氢与所取溶液的质量比即可得过氧化氢溶液中溶质的质量分数.
点评:本题考查了利用过氧化氢制取氧气的操作及实验分析、利用化学方程式推断化学式、根据化学方程式的计算及有关溶液的溶质质量分数的计算等相关知识.



 2H2O+O2↑
2H2O+O2↑ =
= x=
x= wg
wg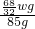 ×100%=
×100%= ×100%=2.5w%
×100%=2.5w% 、0.025w、
、0.025w、 ×100%].
×100%].

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案