
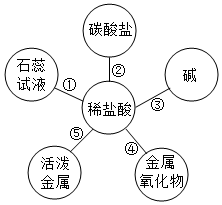
 构建模型和构建知识网络是化学学习中重要的学习方法,小梦同学在学习“常见的酸和碱”知识后,结合常见盐酸的性质与变化绘制出如图“-”两端的物质都能够反应.请回答下列问题.
构建模型和构建知识网络是化学学习中重要的学习方法,小梦同学在学习“常见的酸和碱”知识后,结合常见盐酸的性质与变化绘制出如图“-”两端的物质都能够反应.请回答下列问题.分析 根据已有的酸的性质进行分析解答,酸能与指示剂、活泼金属、金属氧化物以及碱和盐发生化学反应,据此解答.
解答 解:(1)如果用石蕊试纸检验稀盐酸呈酸性,应该选择蓝色石蕊试纸,故填:B;
(2)在镁、锌、铁和铜四种金属中,能与稀盐酸反应的金属且溶液颜色由无色变成变成浅绿色的金属是铁,故填:铁.
(3)根据盐酸能与金属氧化物反应,盐酸可以用于金属表面除锈,故填:用于金属表面除锈.
(4)人体胃液中含有少量盐酸能与氢氧化铝反应生成氯化铝和水,属于复分解反应,故填:3HCl+Al(OH)3═AlCl3+3H2O,复分解.
故答案为:
(1)B;(2)铁.(3)用于金属表面除锈.(4)3HCl+Al(OH)3═AlCl3+3H2O,复分解.
点评 本题考查的是常见的酸的性质,完成此题,可以依据已有的知识进行.


科目:初中化学 来源: 题型:选择题
| A. | CO2 | B. | H2O | C. | O2 | D. | H2O2 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com