
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
分析 (1)氢氧化钙的溶解度随温度升高而减小,多数物质的不饱和溶液变为饱和溶液,常用的方法有:增加溶质、蒸发溶剂、降低温度,据此进行填空.
(2)根据溶解度的含义进行分析计算.
(3)据Ca(OH)2和NaOH的溶解度受温度影响情况分析提纯NaOH晶体的方法.
解答 解:(1)氢氧化钙的溶解度随温度升高而减小,升高温度,氢氧化钙的溶解度减小,能使接近饱和的Ca(OH)2溶液变成饱和溶液,或者加入氢氧化钙;
故答案是:加入氢氧化钙(或升高温度);
(2)由于在20℃时,NaCl的溶解度是91g,所以,由溶解度的含义可知,将191g饱和溶液蒸发10g水后,再降温到20℃,可析出NaCl晶体的质量为19.1g,
故答案是:19.1 g;
(3)Ca(OH)2的溶解度随温度的升高而减小,NaOH的溶解度随温度的升高而增大,所以要从60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液中得到较纯净的NaOH晶体,应采取降温结晶,然后过滤的物理方法;
故答案是:降温结晶,过滤.
点评 了解溶解度的含义、饱和溶液和不饱和溶液相互转化方法,以及观察图表信息、并能用来分析解题是解答此题的关键.


科目:初中化学 来源: 题型:解答题
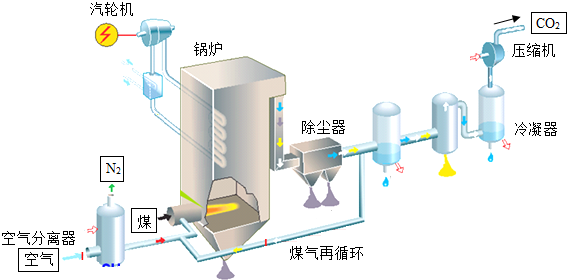
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
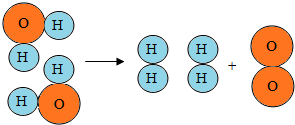 水是生命之源,人类的日常生活与工农业生产都离不开水.
水是生命之源,人类的日常生活与工农业生产都离不开水.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 | 分析及结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该物质由5种元素组成 | |
| B. | 该物质中NH4+和SO42-的微粒个数比为1:2 | |
| C. | 该物质中铝元素的化合价为+3价 | |
| D. | 该物质中氢元素和硫元素的质量比是1:8 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图是“XXX”钙片商品标签图.根据标签信息完成下列题.
如图是“XXX”钙片商品标签图.根据标签信息完成下列题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com