
【题目】某中学开展化学实验考查,考查内容由学生抽签决定,小明同学抽签后来到实验室,实验台上为他准备的药品有:过氧化氢溶液、稀盐酸、稀硫酸、高锰酸钾固体、氯酸钾固体、二氧化锰粉末、大理石颗粒,实验台上还准备了下列仪器:
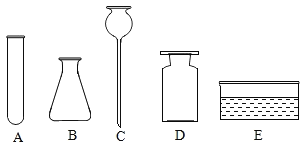
(1)写出下列仪器的名称:B______________。
(2)利用题中药品和 A-I 中仪器可以制取较多量的二氧化碳,要组装发生装置和收集装置,小明选择的仪器是______________(填序号),反应的化学方程式为___________。
(3)利用上述仪器和药品可以制取氧气,小明选择的药品是__________(写名称),若用如图 1 装置装满水,用于收集氧气,进气口应为_________________端(选填“a”或“b”)。
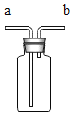
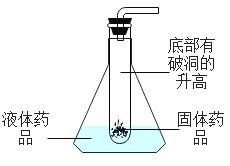
图1 图2
(4)图2是利用报废试管设计的制二氧化碳的发生装置,该设计除了废物利用的优点外,请另写一个优点 _______________________。
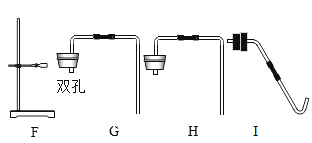
(5)过氧化钠(Na2O2)常温下能与二氧化碳发生反应。将二氧化碳发生装置与图 3 装置(气密性良好)连接,过一段时间后,图3中G 烧杯的澄清石灰水变浑浊,a 处带火星的小木条复燃。
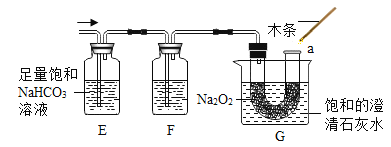
图3
①E 装置的作用是除去二氧化碳中_____________,F 装置里的试剂是___________________。
②G 中饱和的澄清石灰水变浑浊,说明过氧化钠与二氧化碳反应______________热(填“放” 或“吸”)。
③结合实验和所学知识得出 CO2 与 Na2O2 反应的生成物为__________(填字母)。
a Na2O 和 O2 b Na2CO3 和 H2 c NaOH 和 O2 d Na2CO3 和 O2
【答案】锥形瓶 BCDFG CaCO3+2HCl=CaCl2+H2O+CO2↑ 过氧化氢溶液和二氧化锰粉末 b 能控制反应的发生与停止 氯化氢气体 浓硫酸 放热 d
【解析】
(1)据图可知仪器B的名称是锥形瓶;
(2)实验室用大理石或石灰石和稀盐酸反应生成氯化钙、二氧化碳和水制取二氧化碳,不需要加热,二氧化碳能溶于水,密度比空气大,只能用向上排空气法收集;所以利用题中药品和 A-I 中仪器可以制取较多量的二氧化碳,要组装发生装置和收集装置,应选择的仪器是BCDFG,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)仪器中没有酒精灯,可以用过氧化氢溶液和二氧化锰粉末在常温下制取氧气;氧气密度比水小,用图1收集氧气,进气口应为端b;
(4)图2是通过提升试管可以实现固体和液体的分离,所以另一个优点是:能控制反应的发生与停止;
(5)①碳酸氢钠能和氯化氢反应生成二氧化碳,所以E 装置的作用是除去二氧化碳中氯化氢气体;由于浓硫酸具有吸水性,所以装置F的作用是除去二氧化碳中的水蒸气;
②由于反应放热,氢氧化钙的溶解度随温度的升高而减小,所以G烧杯中澄清石灰水变浑浊的原因是:反应放热,使溶液温度升高,氢氧化钙的溶解度变小,使固体从溶液中析出,溶液变浑浊;
③由题意可知,二氧化碳和过氧化钠反应生成氧气,由质量守恒定律可知,另一种物质应是碳酸钠。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:初中化学 来源: 题型:
【题目】阅读下列材料,回答相关问题。
(材料1)2010 年 12 月 14 日下午,以“低碳生活”为主题的专题展览在中国科技馆正式开展。本次展览旨在引导公众改变生活观念,减少二氧化碳排放。展览共设 5 个分主题展区。
(1)地球村的“碳”危机,展示人类过度开发、高碳排放所造成的恶果,如温室气体产生的温室效应。二氧化碳、氧化亚氮(N2O)、甲烷和臭氧(O3)是地球大气中主要的温室气体,其中甲烷的化学式为___________。
(2)高科技的减“碳”术。为限制二氧化碳等温室气体的排放量,科学家采取“组合转化”技术,将二氧化碳和氢气在催化剂和加热条件下转化为一种重要的化工原料乙烯(C2H4)和水,该反应的化学方程式为_______________。
(3)新生活的低“碳”路。下列符合低碳生活理念的是___________(填序号)。
A少买不必要的衣服
B使用节能电器
C洗碗时不间断地放水冲洗
D少开私家车,多乘公共交通工具
(材料2)氨基钠(NaNH2)是合成维生素 A 的原料。工业上将钠于 97 ~ 100 ℃熔融,向反应容器中缓慢通入无水的液氨(NH3),再加热至 350 ~ 360 ℃生成氨基钠和氢气。
(1)下列说法中,正确的是______。
A钠可能与水反应
B钠的熔点比铁的熔点低
C维生素 A 中一定含有钠元素
(2)制备氨基钠的化学方程式为______。
(3)周期表中钠元素的信息如图所示,其原子的核外电子数为_____。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们在教材中看到了下面的图示,想到了用天然气烧水,于是整合了火力发电和烧水的流程如下图,试回答下列问题。

(1)烧煤发电(火力发电)时的能量转化是_____;
(2)烧水的水壶最好使用的材料是(____)
A 焊锡
B 钛合金
C 不锈钢
D 生铁
(3)含锡(Sn)的矿石主要是锡石,主要成分为二氧化锡,锡的冶炼可以用焦炭高温还原锡石,写出用焦炭炼锡的化学方程式_____,反应过程中锡元素的化合价变化为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】能源的利用与社会可持续发展密切相关。
(1)煤燃烧时产生NO2、_____等气体,这些气体或气体在空气中发生反应后的生成物溶于雨水,会形成酸雨。
(2)“低碳”是一种生活理念,也是一种生活态度。下列做法中不符合“低碳”要求的是_____
A 节约纸张
B 大量使用化石燃料
C 提倡使用节约技术和节能产品
D 尽量乘坐公交车
(3)在高温下,工业上以赤铁矿(主要成分是Fe2O3)和一氧化碳反应来炼铁的化学方程式为_____。
(4)在一定条件下,甲烷(CH4)和水反应(未配平)的微观示意图如图所示。

该反应中两种生成物Z和W的分子个数比为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习化学能培养我们的学科素养,下列说法不正确的是
A.变化与守恒:2NaCl + 2H2O![]() 2X + Cl2↑+ H2↑中,X 的化学式是 NaOH
2X + Cl2↑+ H2↑中,X 的化学式是 NaOH
B.模型与推理:活泼金属与稀盐酸反应有气体产生,则与稀盐酸反应有气体生成的一 定是活泼金属
C.宏观与微观:活性炭可以使红墨水褪色,原因是它具有疏松多孔的结构
D.实验与探究:往水样中加入肥皂水后振荡,出现较多泡沫,说明该水样是软水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列方法不能达到除杂目的的是( )
选项 | 物质(括号内为杂质) | 方法 |
A | N2(O2) | 将混合气体通过灼热铜网 |
B | Fe粉(Cu粉) | 加入足量稀H2SO4充分反应,过滤,洗涤,干燥 |
C | CaO(CaCO3) | 高温煅烧 |
D | FeCl2溶液(CuCl2) | 加入足量Fe粉,充分反应后过滤 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属在生产、生活中应用广泛。
(1)一氧化碳还原氧化铁的方程式为__________________。冶炼 16t 氧化铁,可得到铁_______t。
(2)铝抗腐蚀性能好,是因为铝与氧气反应,在其表面生成一层致密的氧化铝薄膜,氧化铝的化学式为_______________。
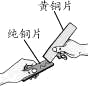
(3)黄铜是铜锌合金,将纯铜片和黄铜片相互刻画(如图所示),纯铜片上留下明显的划痕,该实验的目的是_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2(Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H 2O),老师给他们提供了一瓶久置的亚硫酸钠溶液,兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
(查阅资料)
① Na2SO3不稳定,在空气中易被氧气氧化成Na2SO4;
②SO32-、SO42-均能与Ba2+反应产生白色沉淀;
③BaSO3 等亚硫酸盐能与稀盐酸反应,其反应原理与 BaCO3等碳酸盐与稀盐酸反应类似。
(1)(提出问题)①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
(分析问题) Na2SO3变质的原因是:_______________________。(用化学方程式表示)
(2) (作出猜想)
猜想1:没有变质,成分是Na2SO3;
猜想 2:完全变质,成分是Na2SO4;
猜想3:_____________。
(实验探究Ⅰ)甲、乙两组分别进行实验探究溶液是否变质:
小组 | 实验操作 | 现象 | 结论 |
甲组 | 取少量样品于试管中加入过量稀盐酸; | 产生气泡 | 没有变质,还是Na2SO3 |
乙组 | 取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。 | 产生白色沉淀后 ________ | 已部分变质 |
甲组同学实验中发生的化学方程式为:________________________。有同学质疑甲组方案不合理,理由是_________________。
(3) (实验探究Ⅱ)甲组设计如下实验装置测定Na2SO3溶液的溶质质量分数。(已![]() )
)

①要测定Na2SO3溶液的溶质质量分数,实验中需要测得的数据是亚硫酸钠溶液样品的质量以及_______质量。
②D装置的作用为______________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】右图为甲、乙两种固体物质(不考虑结晶水) 的溶解度曲线。下列说法错误的是
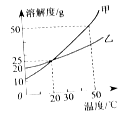
A.20 ℃时,甲、乙具有相同的溶解度
B.甲、乙的溶解度都随温度的升高而增大
C.20 ℃时,可以配制溶质的质量分数为25%的甲溶液
D.50℃时,甲和乙各30g分别加入100g水中,充分溶解后同时等速降温,则乙溶液中先有固体出现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com