
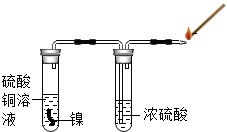
 某研究性学习小组的同学为探究金属镍(Ni,银白色金属)和铜的活动性顺序,进行了一系列实验活动.请你一起参与他们的活动,并回答有关问题.
某研究性学习小组的同学为探究金属镍(Ni,银白色金属)和铜的活动性顺序,进行了一系列实验活动.请你一起参与他们的活动,并回答有关问题.| 实验方案 | 实验现象 | 实验结论 |
| 将金属镍加入到盛有硫酸铜溶液的试管中 | 溶液的颜色变浅,有红色固体析出 | 镍比铜的金属活动性强 |
分析 探究活动一、将金属镍加入到盛有硫酸铜溶液的试管中,由实验结论中“镍比铜的金属活动性强”可知镍可把铜从硫酸铜溶液中置换出来去分析;
【分析推理】
根据质量守恒定律:化学反应前后 元素种类不变去分析;
【设计方案】
从氢气是可燃性气体,浓硫酸具有吸水性去分析;
【评价与反应】
根据质量守恒定律,化学反应前后元素的种类不变.要验证气体中含有氢元素,将其点燃,看生成物中是否有水生成.
解答 解:探究活动一、将金属镍加入到盛有硫酸铜溶液的试管中,由实验结论中“镍比铜的金属活动性强”可知镍可把铜从硫酸铜溶液中置换出来,其反应的化学方程式为:Ni+CuSO4=NiSO4+Cu;由于有铜生成,所以会有红色的物质出现;
【分析推理】
由于反应物中不含碳元素,根据质量守恒定律:化学反应前后 元素种类不变;可知不可能是二氧化碳或一氧化碳;由题意可知:二氧化硫能溶于水,且水溶液应该呈酸性能使紫色石蕊溶液变红;
【设计方案】
由题目中结论该气体可能是氢气,由于氢气是可燃性气体,所以使用时要检验氢气的纯度;浓硫酸具有吸水性,可除去气体中的水分;
【评价与反应】
根据质量守恒定律,化学反应前后元素的种类不变.要验证气体中含有氢元素,可在点燃气体的火焰上方罩一个干冷的烧杯,如果烧杯内壁产生水珠,说明生成了水,水是由氢元素和氧元素组成的,从而证明反应物中含有氢元素;
故答案为:在点燃气体的火焰上方罩一个干冷的烧杯,烧杯内壁产生水珠.
答案:探究活动一、红; Ni+CuSO4=NiSO4+Cu;
【分析推理】反应物中不含碳元素,化学反应前后 元素种类不变;紫色石蕊溶液
【设计方案】检验气体纯度; 除去气体中的水分;
【评价与反应】在点燃气体的火焰上方罩一个干冷的烧杯,烧杯内壁产生水珠.
点评 要会利用金属活动顺序表设计实验,去验证金属的还原性强弱.前边的金属会把后边的金属从其盐溶液中置换出来.灵活运用质量守恒定律等.


 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 判断 | 依据 |
| 不是KMNO4 | KMNO4能溶于水形成紫红色溶液 |
| 不是K2MnO4(填化学式) | 冲洗试管时出现深绿色溶液,说明该物质能溶于水 |
| 是MnO2 | 其他实验用过MnO2,知道它是不溶于水的黑色固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验 | 现象 | 结论 |
| 实验一:取滤液,向其中滴入少量碳酸钠溶液 | 无明显现象 | 猜想二不成立 |
| 实验二:另取滤液,向其中加入足量稀盐酸 | 先无变化后产生气泡 | 猜想三成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验方案 | |
| 方案A |  |
| 方案B |  |
| 方案C | 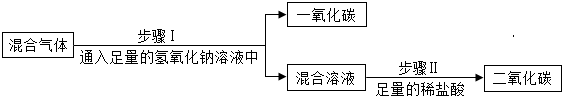 |
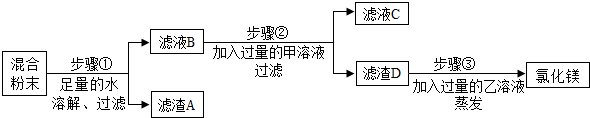
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com