
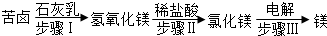

分析 (1)根据质量守恒定律可以书写化学方程式,可燃冰是一种比较理想的燃料进行解答;
(2)根据反渗析法淡化海水是利用海水中各成分的颗粒大小不同分离出淡水、将高盐度浓缩海水进行蒸发结晶可以分离得到粗盐以及复分解反应的含义进行解答.
①从海水中获取淡水.目前能规模化和产业化淡化海水的方法主要是膜法和热法;
②氯化钠的溶解度受温度影响变化不大,所以将高盐度浓缩海水进行蒸发结晶可以分离得到粗盐;
③苦卤本身含有MgCl2,又经历了步骤Ⅰ、Ⅱ的转化过程,其目的是富集氯化镁,除去杂质获得比较纯净的氯化镁并写出化学方程式;
④以海水中获得食盐为原料制取纯碱,粗盐水加入石灰乳是氯化镁和氢氧化钙反应生成氯化钙和氢氧化镁沉淀,氯化钙和碳酸钠反应生成氯化钠和碳酸钙沉淀;
a、经过流程Ⅰ过滤后得到沉淀是Mg(OH)2 CaCO3;
b写出流程Ⅱ中发生的总反应;
c、氨气溶于水溶液呈碱性;
解答 解:(1)甲烷燃烧能生成水和二氧化碳,反应的化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.煤、石油燃烧时能够产生大量的二氧化硫、一氧化碳、氮氧化物等物质,这些物质是空气的主要污染物,而可燃冰燃烧的产物是水和二氧化碳,不污染环境.
故填:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;燃烧的产物是二氧化碳和水,不污染环境.
(2)①从海水中获取淡水.目前能规模化和产业化淡化海水的方法主要是渗透法或蒸馏法;故答案为:渗透法或蒸馏法;
②氯化钠的溶解度受温度影响变化不大,所以将高盐度浓缩海水进行蒸发结晶可以分离得到粗盐;故答案为:蒸发结晶;
③苦卤本身含有MgCl2,又经历了步骤Ⅰ、Ⅱ的转化过程,其目的是富集氯化镁,除去杂质获得比较纯净的氯化镁;无水MgCl2制取镁的化学方程式为MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;故答案为:富集氯化镁,除去杂质获得比较纯净的氯化镁;MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
④以海水中获得食盐为原料制取纯碱,粗盐水加入石灰乳是氯化镁和氢氧化钙反应生成氯化钙和氢氧化镁沉淀,氯化钙和碳酸钠反应生成氯化钠和碳酸钙沉淀,
故a、经过流程Ⅰ过滤后得到沉淀是Mg(OH)2、CaCO3;故答案为:Mg(OH)2、CaCO3;
b、流程Ⅱ中发生的总反应为NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3;故答案为:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3;
c、氨气溶于水溶液呈碱性,故氨气在制碱过程中作用是使溶液显碱性,有利于二氧化碳的吸收;
故答案为:使溶液显碱性,有利于二氧化碳的吸收.
点评 本题较难,考查海水资源的利用,学生应熟悉粗盐提纯及物质转化中的化学反应并利用信息来综合解答,在物质转化中应学会利用组成的差异来选择合适的试剂.


 高中必刷题系列答案
高中必刷题系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
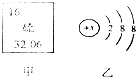 (4分) 图甲是某元素在元素周期表中的部分信息,图乙是该元素的一种粒子结构示意图.
(4分) 图甲是某元素在元素周期表中的部分信息,图乙是该元素的一种粒子结构示意图.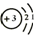 则锂离子的符号为Li+.
则锂离子的符号为Li+.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 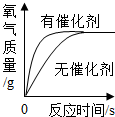 用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 | |
| B. | 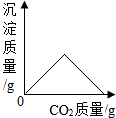 表示澄清石灰水中持续通入CO2 表示澄清石灰水中持续通入CO2 | |
| C. | 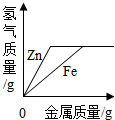 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 | |
| D. | 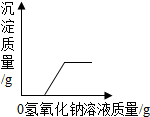 向一定质量的氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 向一定质量的氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图是配制好的盐酸溶液的标签,请根据标签上的文字信息,进行计算:某纯碱样品中含有少量氯化钠.为测定样品中碳酸钠的质量分数,现称取该样品11.0g,放入烧杯中加水完全溶解后滴加上述配制的盐酸溶液至完全反应,最后测得生成气体的质量为4.4g,计算:
如图是配制好的盐酸溶液的标签,请根据标签上的文字信息,进行计算:某纯碱样品中含有少量氯化钠.为测定样品中碳酸钠的质量分数,现称取该样品11.0g,放入烧杯中加水完全溶解后滴加上述配制的盐酸溶液至完全反应,最后测得生成气体的质量为4.4g,计算:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 地壳中含有丰富的氧、硅、铝、铁等元素.结合如图分析,关于这四种元素的说法错误的是( )
地壳中含有丰富的氧、硅、铝、铁等元素.结合如图分析,关于这四种元素的说法错误的是( )| A. | 氧原子的核电荷数为8 | |
| B. | 硅元素属于非金属元素 | |
| C. | 铝与氧元素形成化合物的化学式为A1203 | |
| D. | 铁的相对原子质量为55.85g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com