实验室获取氮气有很多种途径,常见的有3种方法.
方法一:将氨气(NH
3)通过赤热的装有氧化铜的玻璃管,生成铜、氮气和水蒸气,除去水蒸气后测得氮气的密度为1.2508g/L.
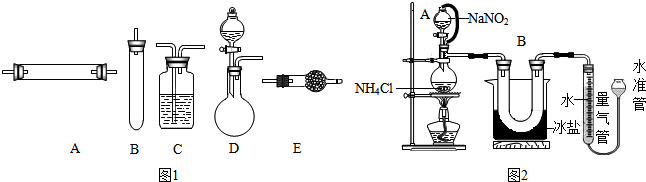
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末,测得该气体的密度为1.2572g/L. 进行实验时可选择的实验仪器如图1所示(省略夹持装置与加热装置).为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置
(选填装置编号)中加入
(填名称)以除去其它杂质气体.
方法三:将亚硝酸钠(NaNO
2)和氯化铵的饱和溶液加热,氮元素全部转化为氮气.如图2是实验室用这种方法制N
2,并测定生成N
2体积的装置(部分装置略去),请回答相关问题.
【查阅资料】
(1)NaNO
2+NH
4Cl
NaCl+N
2↑+2H
2O(此反应会放出大量的热);
(2)B部分中冰盐是冷凝作用
【实验探究】
①
;
②20℃时,取含溶质0.21g饱和NH
4Cl溶液放入烧瓶,连接装置;
③调节水准管,使其与量气管中液面相平,记录量气管中水面读数为12.0mL;
④打开分液漏斗活塞,逐滴滴入饱和NaNO
2溶液,加热至反应发生,移走酒精灯;
⑤烧瓶中不再产生气泡时,关闭活塞;
⑥待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为100.0mL;
⑦处理剩余药品,整理实验台.
【实验分析及数据处理】
(1)加入药品前必须进行的实验①是
;
(2)步骤④中,移走酒精灯的目的是
;
(3)计算生成氮气的质量和密度.(计算过程中以及最终数据均保留2位小数)
【解释与结论】
1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比其他方法得到的纯氮气密度总是偏大5‰左右.若实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因是
(已知:相同条件下,气体的相对分子质量越大,密度就越大)
【反思与评价】
(1)装置中A部分的分液漏斗与蒸馏瓶之间连接的导管所起的作用是
A.防止NaNO
2饱和溶液蒸发 B.保证实验装置不漏气
C.使NaNO
2饱和溶液顺利滴下 D.防止溶液冲入U形管
(2)科学家瑞利仅仅是从小数点第三位数的差别,发现了新物质.这启示我们在今后的学习和生活中要学习科学家的
.
A.严谨求实的科学态度和敢于怀疑的批判精神
B.科学研究中遇到疑惑就趁早放弃,不要浪费时间
C.不能因为微小的差异而放过一次成功的机会
D.要相信权威,权威一定是正确的.




 名校课堂系列答案
名校课堂系列答案

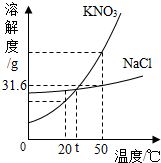 硝酸钾是初中化学常见的一种物质.请按要求填空:
硝酸钾是初中化学常见的一种物质.请按要求填空: