
| A. | 检验NH4Cl溶液和Na2SO4溶液;所用试剂或方法:NaOH溶液或Ba(OH)2溶液 | |
| B. | 区分失去标签的白酒和白醋:所用试剂或方法:闻气味 | |
| C. | 除去生石灰中含有的杂质石灰石:所用试剂或方法:水或稀盐酸 | |
| D. | 除去NaCl溶液中含有的少量Na2CO3:所用试剂或方法:稀盐酸 |
分析 A、根据铵态氮肥与碱性物质混合后能放出有刺激性气味的氨气,进行分析判断.
B、鉴别物质时,首先对需要鉴别的物质的性质进行对比分析找出特性,再根据性质的不同,选择适当的试剂,出现不同的现象的才能鉴别.
C、除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
D、除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、NH4Cl溶液能与NaOH溶液或Ba(OH)2溶液反应出有刺激性气味的氨气,Na2SO4溶液与氢氧化钠溶液不反应,与氢氧化钡溶液反应生成硫酸钡白色沉淀,能出现两种明显不同的现象,可以鉴别,故选项不符合题意.
B、白酒和白醋的气味不同,用闻气味可以区分失去标签的白酒和白醋,故选项不符合题意.
C、生石灰能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则;生石灰和石灰石均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则;故选项符合题意.
D、Na2CO3能与稀盐酸反应生成氯化钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项不符合题意.
故选:C.
点评 物质的鉴别与除杂是中考的重点,也是难点,在解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:初中化学 来源: 题型:选择题
| A. | 饱和溶液变为不饱和溶液 | |
| B. | 溶液中析出晶体后仍为饱和溶液 | |
| C. | 溶液中析出晶体后变为不饱和溶液 | |
| D. | 溶液中不析出晶体,但仍为饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 干燥的药品可以直接放在托盘天平上称量质量 | |
| B. | 向容器中装药品时,应先装液体药品,再装固体药品 | |
| C. | 加热烧杯、试管中的液体时,需用酒精灯隔着石棉网加热 | |
| D. | 收集有氧气的集气瓶,应盖着毛玻璃片,正放在实验桌上 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 进入矿井前做灯火实验 | |
| B. | 夜晚发现家用燃气泄漏需开灯检查 | |
| C. | 为了勤俭节约,可以食用霉变不严重的大米 | |
| D. | 浓硫酸滴在皮肤和衣物应先用大量水冲洗 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 温度 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | |
| 溶解度 | NaCl | 35.7g | 36.0g | 36.6g | 37.3g | 38.4g |
| KNO3 | 13.3g | 31.6g | 63.9g | 110g | 169g | |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2SO4 Na2O MgCl2 C CO | B. | Mg(OH)2 CuSO4 CaO C CO2 | ||
| C. | MgSO4 KOH NaCl O2 SO3 | D. | HCl NaOH NH4Cl O2 P2O5 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
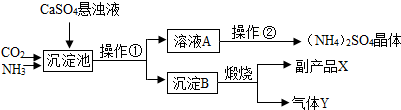
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com