
| A. | Fe+2HCl→FeCl2+H2↑ | B. | H2+Cu→Cu+H2O | ||
| C. | Fe2O3+3CO→2Fe+3CO2 | D. | Fe+CuSO4→Cu+FeSO4 |
分析 有元素化合价升降的反应为氧化还原反应;由题意,符合要求的选项应是氧化还原反应,但不是置换反应,最简单的方法是判断是否是置换反应,把是置换反应的选项排除;置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,据此进行分析判断.
解答 解:A、Fe+2HCl→FeCl2+H2↑,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故选项错误.
B、H2+Cu→Cu+H2O,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故选项错误.
C、Fe2O3+3CO→2Fe+3CO2,该反应的反应物均为化合物,不属于置换反应;且该反应前后,铁元素由+3价→0价,碳元素由+2价→+4价,有元素化合价的升降,属于氧化还原反应,故选项正确.
D、Fe+CuSO4→Cu+FeSO4,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故选项错误.
故选:C.
点评 本题难度不大,掌握氧化还原反应的特征、置换反应的特征(“单化变单化”)是正确解答本题的关键.


 智能训练练测考系列答案
智能训练练测考系列答案科目:初中化学 来源: 题型:解答题
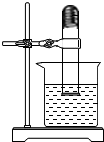 把一团光亮的细铁丝塞入大试管中,将试管倒插水中后再固定好(如图),放置足够的时间(约一周,室温不变)后,观察到铁丝表面有铁锈生成,其主要成分是Fe2O3,(化学式).同时,试管内水面将上升,请写出防止上述现象发生的措施刷漆.(至少写一条)
把一团光亮的细铁丝塞入大试管中,将试管倒插水中后再固定好(如图),放置足够的时间(约一周,室温不变)后,观察到铁丝表面有铁锈生成,其主要成分是Fe2O3,(化学式).同时,试管内水面将上升,请写出防止上述现象发生的措施刷漆.(至少写一条)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子是由原子构成的 | |
| B. | 分子是保持物质性质的一种微粒 | |
| C. | 分子不一定比原子大 | |
| D. | 在分子中电子总数等于构成该分子的各原子的电子数总和 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用熟石灰改良过的酸性土壤.不能立即施加氮肥 | |
| B. | 将草木灰(主要成分是碳酸钾)和碳铵混合施用有利于提高肥效 | |
| C. | 化肥施加过多会随雨水流入河中,造成水华现象 | |
| D. | 铵态氮肥不能与碱性物质混合施用,是由于二者反应降低肥效. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物 质 | 所含杂质 | 除去杂质的方法 | |
| A | Cu(NO3)2溶液 | AgNO3 | 加过量铜粉,过滤 |
| B | O2 | CO2 | 通过灼热的铜网 |
| C | KCl溶液 | BaCl2 | 加适量的Na2SO4溶液,过滤 |
| D | CO2 | HCl | 通过盛有NaOH溶液的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com