
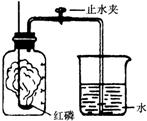
(14分)某同学设计右图所示的实验装置,进行一氧化碳还原氧化铜的实验。试回答:

(l)该装置存在的一个主要问题是 ;
你的改进方法是 .
(2)实验开始时,是先 ,后 ;
目的是 .
(3)实验结束时,是先 ,后 ;
目的是 .
(4)实验过程中,图中A处能观察到的实验现象是 ;
发生反应的化学方程式为 。
B处观察到的实验现象是 。
发生反应的化学方程式为 。
科目:初中化学 来源: 题型:阅读理解
 25、2010年4月14日07时49分,青海玉树发生了7.1级地震,震后当地生态环境和生活条件受到极大破坏,水源受到一定程度污染.灾区人们日常生活用水必需经过一系列的精华处理才能使用.
25、2010年4月14日07时49分,青海玉树发生了7.1级地震,震后当地生态环境和生活条件受到极大破坏,水源受到一定程度污染.灾区人们日常生活用水必需经过一系列的精华处理才能使用.查看答案和解析>>
科目:初中化学 来源: 题型:
 14、某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
14、某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:查看答案和解析>>
科目:初中化学 来源: 题型:
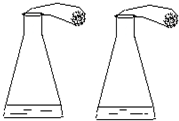 实验室有失去标签的两瓶白色粉末药品,分别是Na2CO3和NaHCO3.某同学设计了下列实验进行鉴别,如图所示.
实验室有失去标签的两瓶白色粉末药品,分别是Na2CO3和NaHCO3.某同学设计了下列实验进行鉴别,如图所示.| 步骤 | 实验操作 |
| 1 | 往两个相同的锥形瓶中分别加入50g溶质质量分数为14.6%的稀盐酸 |
| 2 | 用相同两只气球,分别装入足量的两瓶中的白色粉末各20g,套在步骤1的锥形瓶口,如图 |
| 3 | 迅速将气球中的药品,倒入锥形瓶中 |
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省镇江市丹徒区九年级中考适应性考试化学试卷(解析版) 题型:探究题
(14分)某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【查阅资料】
①该厂采用“侯氏制碱法”生产的化工产品为纯碱和氯化铵。
②生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质。
③生产原理:NaCl+ NH3 + CO2 + H2O= NaHCO3↓+ NH4Cl,分离得晶体A,并使其充分受热,即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为 。
④氯化铵分解的化学方程式是NH4Cl △ NH3↑+HCl↑。
⑤部分生产流程如下图所示:
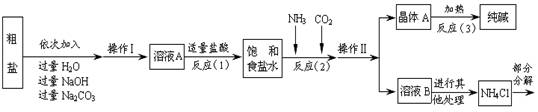
【问题讨论】
(1)溶液A中的溶质有NaCl和 、 ,操作Ⅱ的名称为 。
(2)上述流程中NaOH溶液的作用是除去粗盐中的 。
(3)写出加入Na2CO3溶液所发生反应的化学方程式 。
(4)上述生产流程中可循环使用的是 (填序号)。
A.CO2 B.NH3 C.HCl D.NaOH
(5)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠:
|
实验步骤 |
实验现象 |
实验结论 |
|
|
|
|
【组成确定】
称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。
(6)由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
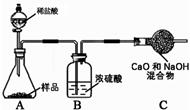
同学们为了测定该纯碱样品的纯度(假定只有(6)中的杂质),设计了如下实验:
(7)甲组实验:取10.0 g纯碱样品,向其中加入过量的盐酸,直至样品中无气泡冒出。充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9 g。计算样品中碳酸钠的质量分数为(写出计算过程,结果保留一位小数)。
(8)乙组实验:取10.0 g纯碱样品,利用右图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量)。实验结束后,发现乙组测定的碳酸钠质量分数偏小,其原因是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
实验室有失去标签的两瓶白色粉末药品,分别是Na2CO3和NaHCO3。某同学设计了下列实验进行鉴别,如下图所示。
| 步骤 | 实验操作 |
| 1 | 往两个相同的锥形瓶中分别加入50g溶质质量分数为14.6%的稀盐酸 |
| 2 | 用相同两只气球,分别装入足量的两瓶中的白色粉末各20g,套在步骤1的锥形瓶口,如图 |
| 3 | 迅速将气球中的药品,倒入锥形瓶中 |
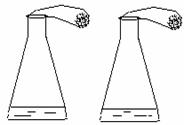
(提示:Na2CO3+2HCl= 2NaCl+H2O+CO2↑  NaHCO3+HCl=NaCl+H2O+CO2↑)
NaHCO3+HCl=NaCl+H2O+CO2↑)
⑴计算两瓶中产生二氧化碳各多少克?
⑵请判断该同学的实验操作能否达到鉴别的目的?并说明理由。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com