
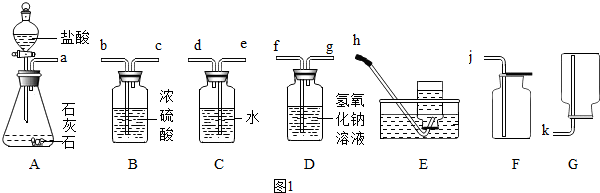

分析 (1)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
氯化氢易溶于水;
二氧化碳的密度比空气大;
浓硫酸具有吸水性,可以用作二氧化碳的干燥剂;
通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
(2)化学反应前后,元素种类不变;
氢氧化钠溶液、碳酸钠溶液都是显碱性的溶液,都能够使酚酞试液变红色;
碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠;
钠和二氧化碳在点燃条件下反应生成碳和碳酸钠;
(3)根据提供的数据可以进行相关方面的计算.
解答 解:(1)A中反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
要达到实验目的,应选用的装置有ABCF;
装置中导管接口从左到右的连接顺序为:a接e、d接b、c接j;
利用A装置,通过过氧化氢和二氧化锰还可以制取氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;ABF;e、d、b、c、j;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)④和⑤不合理,因为反应物中不含有氢元素,因此不可能生成氢氧化钠和碳酸氢钠;
向另一份中先加入过量CaCl2溶液,出现白色沉淀,说明溶液中含有碳酸钠,过滤,向滤液里滴加酚酞溶液,无明显现象,说明溶液中不含有氢氧化钠,因此白色物质为碳酸钠;
钠在二氧化碳中燃烧的化学方程式为:4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$C+2Na2CO3
故填:④和⑤,反应物中不含有氢元素,因此不可能生成氢氧化钠和碳酸氢钠;碳酸钠;4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$C+2Na2CO3.
(3)设该溶液中碳酸钠质量为x,与氯化钙反应生成氯化钠质量为y,
Na2CO3+CaCl2═CaCO3↓+2NaCl,
106 100 117
x 10g y
$\frac{106}{x}=\frac{100}{10g}=\frac{117}{y}$
x=10.6g,y=11.7g,
则碳酸钠的总质量为:10.6g+10.6g=21.2g,
反应后溶液中溶质的质量分数为:$\frac{11.7g}{10.6g+50g+111g-10g}$×100%=7.2%,
答案:
(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;ABCF;e、d、b、c、j;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)[做出猜想]:④和⑤,反应物中不含有氢元素,因此不可能生成氢氧化钠和碳酸氢钠;碳酸钠;4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$C+2Na2CO3.
[得出结论]碳酸钠;4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$C+2Na2CO3.
(3)Na2CO3固体的质量为21.2 g;NaCl溶液的质量分数为7.2%.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 ”代表氧原子,用“
”代表氧原子,用“ ”代表碳原子,
”代表碳原子,
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com