
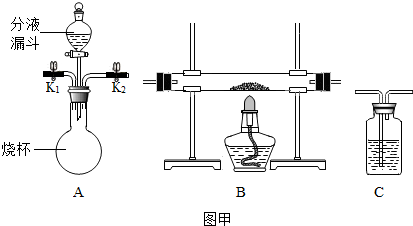
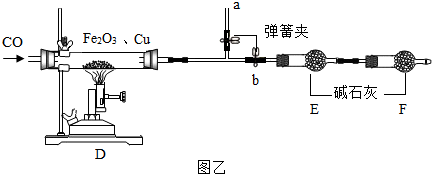
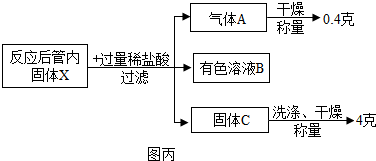
分析 (1)根据二氧化碳会与氢氧化钠反应,一氧化碳不会与氢氧化钠反应,硫酸和氢氧化钠会生成二氧化碳气体,洗气应该是长进短出进行分析;
(2)根据A装置制取氧气的反应物是固体和液体,反应条件是常温进行分析;
(3)根据碳和氧气反应生成二氧化碳,检验二氧化碳常用澄清石灰水,二氧化碳和氢氧化钙反应会生成碳酸钙沉淀进行分析;
(4)根据甲烷和氧化铜在加热的条件下生成铜、二氧化碳和水进行分析;
(5)根据氢氧化钠吸入二氧化碳使烧瓶内压强减小;浓硫酸具有吸水性,是为了验证反应后是否有水生成;氢氧化钠溶液质量增加说明有二氧化碳,再根据反应后生成水,判断含有甲烷进行分析;
(6)根据实验室常用仪器的名称进行分析;
根据一氧化碳和氧化铁在高温的条件下反应生成铁和二氧化碳,一氧化碳有毒,需要尾气处理进行分析;
(7)根据通入的一氧化碳是过量的,不能作为反应数据,完全反应后玻璃管内固体质量m2,必须知道玻璃管的质量进行分析;
(8)①根据铁会与盐酸反应生成氯化亚铁和氢气,铜不会与盐酸反应进行分析;
②根据加入的盐酸是过量的进行分析;
③根据氢气的质量可求出铁的质量,根据铁元素的质量可求出氧化铁的质量进行分析;
(9)根据氧化铁会与盐酸反应生成氯化铁和水,铜不会与盐酸反应,过滤、洗涤、干燥可以得到铜进行分析.
解答 解:(1)二氧化碳会与氢氧化钠反应,一氧化碳不会与氢氧化钠反应,硫酸和氢氧化钠会生成二氧化碳气体,洗气应该是长进短出,所以分液漏斗中可装入适量稀硫酸,先关闭分液漏斗活塞,打开活塞K1和K2通入混合气体时,可先分离得到CO,再关闭K1,打开分液漏斗活塞使液体流下,反应后可再得到CO2,若要使实验成功,装置必需进行的改进措施是:将A装置内左侧导管伸入液面下;
(2)A装置制取氧气的反应物是固体和液体,反应条件是常温,所以是过氧化氢制取氧气,过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(3)碳和氧气反应生成二氧化碳,检验二氧化碳常用澄清石灰水,所以除用装置A、B外,还需要补充的装置有C,该装置中应盛澄清石灰水,二氧化碳和氢氧化钙反应会生成碳酸钙沉淀,所以实验中可观察到该装置中的现象是澄清石灰水变浑浊,化学方程式为:Ca(OH)2+CO2 =CaCO3↓+H2O;
(4)甲烷和氧化铜在加热的条件下生成铜、二氧化碳和水,化学方程式为:CH4 +4CuO$\frac{\underline{\;\;△\;\;}}{\;}$4Cu+CO2+2H2O;
(5)氢氧化钠吸入二氧化碳使烧瓶内气体压强减小,通入氮气防止液体倒吸;
为了验证通过B装置后是否有水生成,所以在通入B装置前将原来的水除掉,再通过B装置看是否有水生成,因为浓硫酸具有吸水性,可以除去水蒸气,所以C中放浓硫酸;
测得烧瓶中溶液的质量为3.1g,比氢氧化钠溶液质量增加了,说明烧瓶中含有二氧化碳,其它气体都不与氢氧化钠反应,第二个C装置的质量增加了0.18g说明生成了0.18g水,所以烧瓶中含有甲烷,
CH4+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$4Cu+CO2+2H2O
320 256 36 固体质量减少:64
0.18g x
$\frac{36}{0.18g}$=$\frac{64}{x}$
x=0.32g,题干中B中固体的质量减少了0.48g,所以气体中有一氧化碳,
所以烧瓶中气体的成分是:CO2、CO和CH4;
(6)通过分析题中所指仪器的作用可知,D装置中用于加热的实验仪器的名称是:酒精喷灯;
一氧化碳和氧化铁在高温的条件下反应生成铁和二氧化碳,化学方程式为:Fe2 O3 +3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,一氧化碳有毒,需要尾气处理,所以该实验的一个明显缺陷是:缺少尾气处理装置;
(7)通入的一氧化碳是过量的,不能作为反应数据,完全反应后玻璃管内固体质量m2,必须知道玻璃管的质量,所以要利用下列有关数据来测定样品中氧化铁的质量分数(假设反应均完全),最少需要测定下列数据中的2个数据;
选择下列最少的数据,
E装置增重的质量就是二氧化碳的质量,通过二氧化碳可以求出参加反应的氧化铁的质量,然后求出氧化铁的质量分数;
Fe2O3-----CO2
160 44
x m3
$\frac{160}{x}$=$\frac{44}{{m}_{3}}$
x=$\frac{40{m}_{3}}{11}$
所以氧化铁的质量分数是:$\frac{40{m}_{3}}{11{m}_{1}}$×100%;
玻璃管内减小的质量就是氧元素的质量,所以
Fe2O3-----3Fe 固体减小质量
160 48
y m1-m2
$\frac{160}{y}$=$\frac{48}{{m}_{1}-{m}_{2}}$
y=$\frac{10}{3}$(m1-m2)
所以氧化铁的质量分数为:$\frac{10({m}_{1}-{m}_{2})}{3{m}_{1}}$×100%;
Fe2O3-----3CO
160 84
z Vρ一氧化碳密度
$\frac{160}{z}$=$\frac{84}{{v}_{{ρ}_{一氧化碳密度}}}$
z=$\frac{40}{21}$Vρ一氧化碳密度
所以氧化铁质量分数为:$\frac{40V{ρ}_{一氧化碳密度}}{21{m}_{1}}$×100%
所以最多有3种方案能计算出样品中氧化铁的质量分数;
(8)①铁会与盐酸反应生成氯化亚铁和氢气,铜不会与盐酸反应,化学方程式为:Fe+2HCl=FeCl2+H2↑;
②加入的盐酸是过量的,所以有色溶液B中的溶质为:FeCl2和HCl;
③设铁的质量为x,
Fe+2HCl═FeCl2+H2↑
56 2
x 0.4g
$\frac{56}{x}$=$\frac{2}{0.4g}$
x=11.2g
所以氧化铁的质量为:$\frac{11.2g×160}{112}$=16g,所以原混合物“氧化铁和铜粉”中铜的质量分数为:$\frac{4g}{4g+16g}$×100%=20%;
(9)氧化铁会与盐酸反应生成氯化铁和水,铜不会与盐酸反应,过滤、洗涤、干燥可以得到铜,所以取一定量氧化铁与铜粉的混合物样品,直接加入足量稀盐酸,充分反应后,过滤,将滤渣洗涤、干燥后后再称量,即为样品中铜的质量.
故答案为:(1)稀硫酸,将A装置内左侧导管伸入液面下;
(2)2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(3)C,澄清石灰水,澄清石灰水变浑浊,Ca(OH)2+CO2 =CaCO3↓+H2O;
(4)CH4 +4CuO$\frac{\underline{\;\;△\;\;}}{\;}$4Cu+CO2+2H2O;
(5)倒吸;浓硫酸;CO2、CO和CH4;
(6)酒精喷灯,Fe2 O3 +3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,缺少尾气处理装置;
(7)2,3;
(8)Fe+2HCl=FeCl2+H2↑,FeCl2和HCl,20%;
(9)洗涤,干燥,铜.
点评 在解此类题时,首先分析题中考查的问题,然后分解成一些简单的小问题,在结合学过的知识和题中所给的提示进行解答.


科目:初中化学 来源: 题型:选择题
| A. | 负极产生的气体可以燃烧 | |
| B. | 产生的H2与O2的质量比为2:1 | |
| C. | 实验证明了分子在化学变化中可分 | |
| D. | 证明了水是由氢、氧元素组成的化合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 二氧化锰是催化剂 | |
| B. | 催化剂能加快化学速率,增加生成物的量 | |
| C. | 没有催化剂,过氧化氢就不能反应 | |
| D. | 在过氧化氢反应中,二氧化锰起到了催化剂作用 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁在氧气中剧烈燃烧,火星四射,生成黑色四氧化三铁,并放热 | |
| B. | 硫在空气中燃烧发出明亮的蓝紫色火焰,生成一种有刺激性气味的气体 | |
| C. | 把盛有浓盐酸的试剂瓶的盖子打开后,瓶口上方会出现白雾 | |
| D. | 向生铁中加入足量稀硫酸,固体完全消失 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com