
【题目】“中国制造”“一带一路”等基础建设都需要用到大量钢铁。
(1)认识铁及其应用
①从微观角度看,铁是由____(填化学符号)构成,其在地壳中的含量居所有元素第____位。
②生铁和钢均是生活中常见的金属材料,它们都属于 __(填“纯净物”或“混合物”)。
③铁锅可用以烹饪,利用了铁的_____性。很多人认为:铁锅炒菜过程中会有少量铁进入人体,与胃液中的盐酸反应,请写出铁与稀盐酸反应的化学方程式_____,该反应的基本反应类型为_____,所以用铁锅炒菜能“补铁”,这里的“铁”指______(填“原子”“单质”或“元素”)。
(2)铁的冶炼
某化学实验小组利用下图装置模拟铁的冶炼并测定某赤铁矿石中氧化铁的质量分数(假设赤铁矿中杂质不参与反应)。
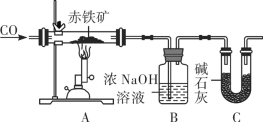
①实验开始时,先进行的操作是____(填字母)。
a 通入一氧化碳 b 加热
②实验过程中观察到装置A中玻璃管内发生的现象是______。
③写出B装置发生反应的化学方程式是__________。
④从环境保护的角度看此实验存在的缺陷是__________。
⑤实验前称量赤铁矿石的质量为20g,通入足量一氧化碳充分反应,测得B装置总质量增加13.2 g。若不考虑实验过程中水分带出的影响,则装置C的作用是________;求该赤铁矿石中氧化铁的质量分数______(请写出计算过程)。
(3)铁的防护
①铁制品暴露于潮湿的空气中,易形成铁锈。由于铁锈结构特点是______,故铁制品表面的铁锈应及时清除,用稀盐酸适时浸泡是清除铁锈的方法之一,铁锈的主要成分与盐酸反应的化学方程式为_________。
②家庭使用的铁锅防锈方法有___________。
【答案】Fe 四(或4) 混合物 导热 ![]() 置换反应 元素 a 红棕色固体逐渐变为黑色
置换反应 元素 a 红棕色固体逐渐变为黑色 ![]() 缺少尾气处理装置(合理即可) 防止空气中二氧化碳进入B装置,引起误差 80% 疏松多孔
缺少尾气处理装置(合理即可) 防止空气中二氧化碳进入B装置,引起误差 80% 疏松多孔 ![]() 保持铁锅表面洁净、干燥
保持铁锅表面洁净、干燥
【解析】
(1)①从微观角度看,铁是由铁原子构成的,原子用元素符号表示,故填:Fe;
地壳中元素含量由多到少依次为:O、Si、Al、Fe、Ca,故铁在地壳中的含量居所有元素第四位;
②生铁和钢都是由铁、碳等两种以上物质混合而成,属于混合物;
③铁锅可用于烹饪,说明铁能导热,故这是利用了铁的导热性;
铁能与稀盐酸反应生成氯化亚铁和氢气,该反应的化学方程式为:![]() ;
;
该反应符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应;
用铁锅炒菜能补铁,这里的“铁”通常指的是铁元素,故填:元素;
(2)①实验开始时,应先通一氧化碳,因为一氧化碳具有可燃性,混有一定量的空气,遇明火会发生爆炸,故应先通一氧化碳,将装置内的空气排尽。
故选a;
②赤铁矿的主要成分是三氧化二铁,呈红棕色,CO与三氧化二铁在高温的条件下反应生成铁和二氧化碳,铁粉为黑色,故装置A中玻璃管内发生的现象是:红棕色固体逐渐变为黑色;
③氢氧化钠能与反应生成的二氧化碳反应生成碳酸钠和水,该反应的化学方程式为:![]() ;
;
④一氧化碳有毒,未反应的一氧化碳排放到空气中会污染空气,应增加尾气处理装置,故从环境保护的角度看此实验存在的缺陷是:缺少尾气处理装置;
⑤实验前称量赤铁矿石的质量为20g,通入足量一氧化碳充分反应,测得B装置总质量增加13.2 g,一氧化碳与赤铁矿中的三氧化二铁在高温的条件下反应生成铁和二氧化碳,氢氧化钠能与二氧化碳反应生成碳酸钠和水,故B装置增加的质量就是反应生成的二氧化碳的质量,氢氧化钠不仅能吸收反应生成的二氧化碳,也能吸收空气中的二氧化碳,故装置C的作用是:吸收空气中的二氧化碳,防止空气中的二氧化碳进入B装置,产生误差,故填:防止空气中二氧化碳进入B装置,引起误差;
解:设该赤铁矿石中氧化铁的质量分数为x

![]() x=80%;
x=80%;
(3)①铁生锈的条件是铁与氧气、水接触,铁锈的结构是疏松多孔,有利于未生锈的铁与氧气、水接触,从而使铁进一步被锈蚀,故铁锈应及时清除,铁锈的主要成分是三氧化二铁,三氧化二铁能与稀盐酸反应生成氯化铁和水,从而除去铁锈,该反应的化学方程式为:![]() ,故填:疏松多孔、
,故填:疏松多孔、![]() ;
;
②铁生锈的条件是铁与氧气、水接触,防止铁生锈,可以隔绝氧气或水,故家庭使用的铁锅防锈方法有:保持铁锅表面洁净、干燥,刷食用油等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】某化学反应的微观过程如下图(其中“![]() ”代表氢原子,“
”代表氢原子,“![]() ”代表氮原子,“
”代表氮原子,“![]() ”代表氧原子),下列叙述中,正确的是
”代表氧原子),下列叙述中,正确的是
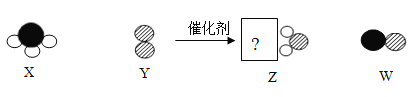
A.该反应类型为置换反应
B.该反应中氧元素的化合价发生了变化
C.所得生成物Z和W的质量比为9:15
D.该反应中原子、分子种类都未发生变化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“配制一定质量分数的溶液”和“粗盐中难溶性杂质的去除”是初中化学的基础实验,请回答下列问题:
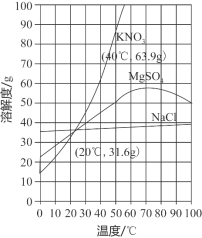
(1)“粗盐中难溶性杂质的去除”实验步骤:
①溶解称取5.0g粗盐,逐渐加入10mL水中,直到不再溶解,剩余粗盐1.2g。
②过滤。
③蒸发,请从溶解度的角度分析,实验中不采用降低溶液温度的方法得到精盐的依据是________。
④计算产率得到精盐3.2g,则精盐的产率为__________(计算结果保留一位小数)。
(2)整个实验中至少要进行__________次称量。
(3)从海水中获胜得的粗盐,经过上述实验得到精盐属于__________(填“混合物”或“纯净物”)。
(4)根据如图所示溶解度曲线,40℃时,向装有50g水的烧杯中加入25gKNO3固体,充分搅拌后,所得溶液的溶质质量分数为_____%(精确到0.1%),将该溶液降温至20℃时,析出KNO3晶体的质量为____g。
(5)若用溶质质量分数为16%的KNO3溶液和蒸馏水配制100g溶质质量分数为10%的KNO3溶液,则需要取蒸馏水的体积为__________ml。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明同学利用不同装置测定空气中氧气的含量。
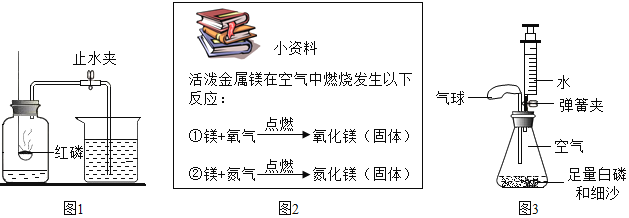
(1)小明先用图1中装置测定空气中氯气的含量。红磷燃烧的符号表达式是______________,实验结束后小明同学得出的结论:空气中氧气的体积小于![]() ,导致实验误差的原因可能是___________(写1条)。
,导致实验误差的原因可能是___________(写1条)。
(2)完成实验后,小明想能否使用其它物质代替红磷进行上述实验,并且查阅了相关资料如图2所示。下列物质中,请你判断不能用于代替红磷进行该实验的有________字母序号)。
A 木炭 B 铁丝 C 镁条 D 硫
(3)小明又设计了图3装置测定空气中氯气的含量
(查阅资料)温度达到![]() 时,白磷可以燃烧。
时,白磷可以燃烧。
(实验准备)锥形瓶内空气体积为![]() ,注射器中水的体积为
,注射器中水的体积为![]() ,该装置气密性良好。
,该装置气密性良好。
(实验探究)装入药品,按图所示连接好仪器,夹紧弹簧夹。先将锥形瓶底部放入热水中,白磷很快被引燃,然后将锥形瓶从热水中取出。
(现象分析)将锥形瓶底部放入热水中,白磷剧烈燃烧,放热;
②在整个实验过程中,可观察到气球的变化是_____________,其原因是______________.
③待白磷熄灭、雏形瓶冷却到室温后,打开弹簧夹,还可观察到的现象是____________;剩余气体的化学性质是____________.
(4)对比改进前的实验,改进后实验的优点是_______________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向200.0 g AgNO3溶液中加入Fe和Cu的混合粉末X g,搅拌,充分反应后过滤、洗涤、干燥得32.4 g固体。向滤液中滴加NaCl溶液,产生白色沉淀。下列说法正确的是
A.干燥所得固体中加入稀盐酸有气体生成B.混合粉末的质量范围是8.4<X<9.6
C.滤液的质量一定大于167.6 gD.原AgNO3溶液的溶质质量分数是25.5%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合下列化学实验装置,回答有关问题。
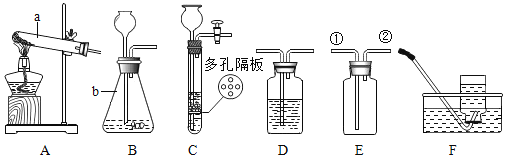
(1)写出图中标有字母的仪器的名称:a___________,b___________ 。
(2)实验室用氯酸钾制取氧气应选择的发生装置是 _______(填代号),反应的化学方程式是__________________,可用_____________法收集氧气。制得的氧气用来做如图所示的实验,发现H中铁丝不燃烧,其原因是__________________。写出G中反应的化学方程式_________________。
(3)实验室制取二氧化碳常用的药品是________________,若用装置E收集二氧化碳,则________________气体应从________(填“①”或“②")端进入;若要获得干燥的二氧化,可将装置B和装置D用胶皮管连接,并在装置D中盛放________________(填物质名称)试剂。
(4)实验室常用装置C代替装置B制取气体,装置C的优点是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
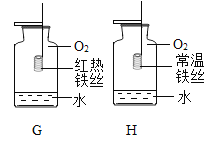
【题目】利用下列装置进行实验室气体制取,有关说法错误的是( )
A.装置A可用于固体加热制气体
B.装置B可随时控制反应的发生与停止
C.装置C可用于收集难溶于水的气体
D.装置D用于排空气法收集氧气时应在b端验满
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4等物质,为了从中提取较纯的氯化镁和氯化钠,设计如图实验方案:
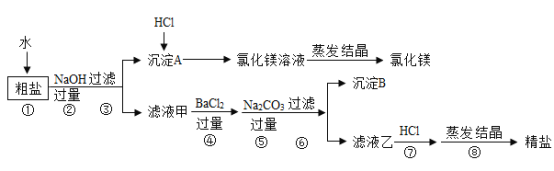
请回答下列问题:
(1)步骤①溶解过程中用玻璃棒搅拌的目的是_____。
(2)步骤④⑤的顺序颠倒会引发的后果是_____。
(3)滤液乙中所含的溶质除氯化钠外还含有_____。
(4)在步骤⑦中若加入的盐酸略过量对实验结果没有影响,其原因是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质的溶解度曲线。
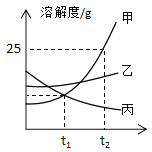
(1)当温度为________℃时,甲、丙两种物质的溶解度相等。
(2)t2℃时,甲的饱和溶液的溶质质量分数为__________。
(3)t2℃时,把乙物质的不饱和溶液变为饱和溶液,可采用的方法有____(写出一种方法即可)。
(4)甲的溶液中混有乙,若提纯甲物质,方法为_________。
(5)把甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是______(填序号)。
A 溶剂的质量一定变小 B 溶质的质量可能不变
C 溶液的质量一定变大 D 该饱和溶液还可以溶解乙物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com