
| A. | 稀硫酸 | B. | 铁 | C. | 石灰水 | D. | 氯化钙 |
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:初中化学 来源: 题型:解答题
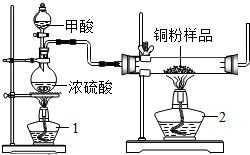 浓硫酸具有脱水性.可以使甲醛(分子式为HCOOH)脱水而获得CO,现拟用如图所示装置(尾气处理部分略)来制取CO,并用CO还原CuO,化学方程式为CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,基于此反应测定某铜粉样品(混有CuO粉末)中金属铜的含量.
浓硫酸具有脱水性.可以使甲醛(分子式为HCOOH)脱水而获得CO,现拟用如图所示装置(尾气处理部分略)来制取CO,并用CO还原CuO,化学方程式为CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,基于此反应测定某铜粉样品(混有CuO粉末)中金属铜的含量.查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 化学反应通常伴有能量变化,凡是伴有能量变化的不一定是化学变化 | |
| B. | 单质中只含有一种元素,则只含有一种元素的物质一定是单质 | |
| C. | 化合物是由不同种元素组成的纯净物,则由不同种元素组成的纯净物一定是化合物 | |
| D. | 一定温度下的不饱和溶液还能溶解溶质,则一定温度下的饱和溶液不能溶解任何物质 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 电极 | 碳棒-铜片 | 碳棒-铁片 | 碳棒-锌片 |
| 电流强度(mA) | 1.43 | 4.26 | 4.63 |
| 电压(V) | 0.6 | 1.2 | 1.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Na+ | B. | H+ | C. | OH- | D. | Cl- |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水→氢气+氧气 | B. | 木炭+氧化铜→铜+二氧化碳 | ||
| C. | 氢气+氧气→水 | D. | 氧化汞→汞+氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
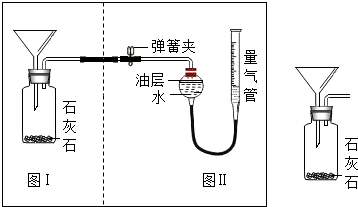 石灰石是一种重要矿石,其主要成分为碳酸钙,在冶金、建材、化工等行业均有广泛用途.某校9年级科学探究小组的同学为了测定某种石灰石样品中碳酸钙的质量分数,设计了如下实验方案:取一定质量的石灰石样品与足量稀盐酸反应,测量反应后生成的CO2的体积,再将体积换算成质量,最后根据CO2的质量计算样品中碳酸钙的质量分数.下图Ⅰ为石灰石与稀盐酸反应的装置,图Ⅱ为测量CO2体积的装置.
石灰石是一种重要矿石,其主要成分为碳酸钙,在冶金、建材、化工等行业均有广泛用途.某校9年级科学探究小组的同学为了测定某种石灰石样品中碳酸钙的质量分数,设计了如下实验方案:取一定质量的石灰石样品与足量稀盐酸反应,测量反应后生成的CO2的体积,再将体积换算成质量,最后根据CO2的质量计算样品中碳酸钙的质量分数.下图Ⅰ为石灰石与稀盐酸反应的装置,图Ⅱ为测量CO2体积的装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com