
【题目】食盐是一种重要的化工原料,请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难容性杂质的实验步骤。![]()
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和。
②蒸发过程中,待 时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制,流程如图:
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是(用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有(用化学式表示)。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100kg,要将其变成20℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是 。(已知:20℃时氯化钠的溶解度为36g。)
【答案】
(1)漏斗;蒸发皿中出现较多固体
(2)Na2CO3+BaCl2=BaCO3↓+2NaCl;NaOH、NaCl、Na2CO3
(3)加入22.4 kg的氯化钠固体
【解析】(1)①去除泥沙的步骤是:溶解:把粗盐放入烧杯中,加水溶解;过滤:架好漏斗,使漏斗下端口紧贴烧杯内壁,沿玻璃棒把上述悬浊液慢慢导入漏斗中;该过程中用到的玻璃仪器主要有烧杯、玻璃棒和漏斗等;②蒸发结晶:将上述滤液倒入蒸发皿中,用酒精灯加热蒸发,待蒸发皿中出现较多量晶体时即停止加热;(2)①碳酸钠可以除去反应中过量的氯化钡和氯化钙,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,化学方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl;②通过分析可知,加入的碳酸钠、氢氧化钠都是过量的,还有生成的氯化钠,所以通过操作Ⅲ所得滤液中的溶质有NaOH、NaCl、Na2CO3;(3)20℃时氯化钠的溶解度为36g,可以通过加入氯化钠固体的方法是溶液达到饱和状态,设需要加入氯化钠为x,![]() =
= ![]() ,解得:x=22.4kg。
,解得:x=22.4kg。
故答案为:(1)漏斗;蒸发皿中出现较多固体(2)Na2CO3+BaCl2=BaCO3↓+2NaCl;NaOH、NaCl、Na2CO3(3)加入22.4 kg的氯化钠固体
(1)根据粗盐提纯的步骤和仪器以及实验的注意事项解答
(2)根据碳酸钠可以除去反应中过量的氯化钡和氯化钙,碳酸钠和氯化钡反应生成碳酸钡和氯化钠解答;根据题中加入的各种除杂试剂进行分析
(3)根据20°是氯化钠的溶解度为36克,计算出所需要的氯化钠


科目:初中化学 来源: 题型:
【题目】图中的A--H是初中化学常见的化合物,其中B是氧化物,白色固体F易溶于水并放出大量的热,G、H是配置农药波尔多液的原料。“—”表示相互能反应,“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
(1)F的化学式是 ,
H的另一种常见用途是。
(2)G和H反应的化学方程式 ,
该反应的基本类型是。
(3)若A、B、E、F是不同类别的化合物,则E和F反应的化学方程式。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为实现“中国梦”,建设美丽城市。从化学视角分析,你认为下列说法正确的是( )
A.鼓励燃煤发电,实现区域电力互惠共享
B.对水源地的水体严格保护
C.增加烟囱高度,减少废气污染
D.大力发展化石能源,满足工业生产需求
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有a、b、c、d四个烧杯中分别盛有50g水,在40℃时,向四个烧杯中分别加入55g、43g、32g、16g硝酸钾,充分溶解后,如图所示。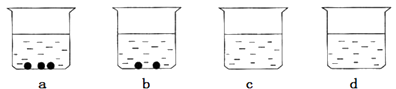
小资料:硝酸钾的溶解度数值如下所示:
项目 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ |
KNO3 | 21g | 32g | 46g | 64g | 86g | 110g | 138g |
上述溶液中,属于不饱和溶液的是( )
A.a
B.b
C.c
D.d
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列选项中物质的俗名、化学式和类别完全正确是()
A.熟石灰 CaO 氧化物
B.小苏打 Na2CO3 盐
C.烧碱 NaOH 碱
D.水银 Ag 单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com