(2013?宝应县二模)甲醛(CH
2O)是世界卫生组织确认的致癌致畸物质之一.
我国规定:室内甲醛含量不得超过8×10
-5mg/L.某研究性学习小组利用KMnO
4和H
2SO
4的混和液测定居室内空气中甲醛的含量.
【实验原理】
KMnO
4和H
2SO
4的混和液与甲醛的反应方程式为:4KMnO
4+5CH
2O+6H
2SO
4=4MnSO
4+2K
2SO
4+5X↑+11H
2O
①其中X的化学式为
CO2
CO2
;
②随着甲醛的不断通入,溶液的PH
变大
变大
(填“变大”、“变小”或“不变”),但由于测定的需要,配制混和液时使用了过量的硫酸,因此反应结束时溶液的PH
<
<
7(填“>”、“<”或“=”).
③随着甲醛的不断通入,溶液的紫红色不断褪去,到刚好变为无色时,通入的甲醛与混和液中的KMnO
4恰好完全反应;此时只要知道原混和液质量以及其中
高锰酸钾
高锰酸钾
的质量分数,就可利用前述反应方程式计算出通入的甲醛质量.
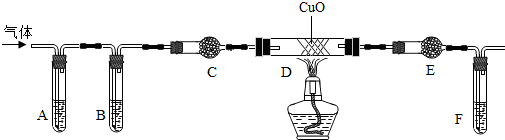
【实验装置】如图1;
【实验步骤】
④检查该装置气密性的方法之一是:打开 a 和b,拨出双孔塞,向集气瓶中加蒸馏水至浸没左导管口约2cm,塞上双孔塞,再关闭
a
a
(填“a”或“b”),最后抽或推注射器,造成左导管与瓶内产生液面差;若液面差稳定,则装置
气密
气密
(填“气密”或“不气密”).
⑤若装置气密,则加混和液前
不要
不要
(填“要”或“不要”) 将集气瓶中蒸馏水先倒出.
⑥向集气瓶中加入5.00g 混和液(其中KMnO
4的质量分数为1.58×10
-4),再向其中加适量蒸馏水,扩大液体的量以利吸收甲醛.
⑦先打开
a
a
(填“a”或“b”),关闭另一个活塞,每次用注射器抽取100mL室内空气,然后进行相反关开活塞的操作,再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应,如此反复多次直至溶液刚好完全褪色,计下推入气体次数.
【数据处理】
⑧若实验中,当第250次将气体压送到洗气瓶中时,溶液的红色刚好褪去,则该居室内空气中甲醛含量
不符合
不符合
规定(填“符合”或“不符合”).
己知:KMnO
4、CH
2O的相对分子质量依次为158、30;1g=1000mg;1L=1000mL
计算过程:
解:设甲醛的质量为x
4KMnO
4 +5CH
2O+6H
2SO
4 =4MnSO
4+2K
2SO
4+5CO
2↑+11H
2O
4×158 5×30
5.00g×1.58×10
-4x
=
x=1.875×10
-4因为每次用注射器抽取100mL室内空气,第250次恰好反应,则通入的空气体积为:100ml×250=25000mL=25L,所以该居室内空气中甲醛的含量
=0.0075mg/L=7.5×10
-3mg/L>8×10
-5mg/L,故不符合
解:设甲醛的质量为x
4KMnO
4 +5CH
2O+6H
2SO
4 =4MnSO
4+2K
2SO
4+5CO
2↑+11H
2O
4×158 5×30
5.00g×1.58×10
-4x
=
x=1.875×10
-4因为每次用注射器抽取100mL室内空气,第250次恰好反应,则通入的空气体积为:100ml×250=25000mL=25L,所以该居室内空气中甲醛的含量
=0.0075mg/L=7.5×10
-3mg/L>8×10
-5mg/L,故不符合
,通入的空气体积为
25
25
L
【误差分析】
⑨某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,你认为其可能的原因是(假设溶液配制、量取过程均无错误):
没有搅拌,甲醛和高锰酸钾反应不完全
没有搅拌,甲醛和高锰酸钾反应不完全
、
空气中的其它气体和高锰酸钾反应
空气中的其它气体和高锰酸钾反应
(要答出2种可能性).
【交流讨论】
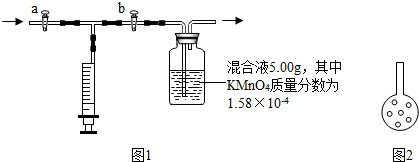
⑩实验后的交流中,有小组成员认为:可将插入混和溶液的管子下端改成具有多孔的球泡(如图2),有利于提高实验的准确度,其理由是
增大了甲醛和溶液的接触面积
增大了甲醛和溶液的接触面积
.



 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案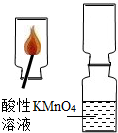 小军进行了下列实验:将数根火柴捆在一起,伸入到一集气瓶中,用另一根火柴点燃,等火柴头燃烧完后取出.迅速将集气瓶口与另一装有酸性KMnO4溶液的集气瓶瓶口对接,振荡,发现红色KMnO4溶液颜色消失.
小军进行了下列实验:将数根火柴捆在一起,伸入到一集气瓶中,用另一根火柴点燃,等火柴头燃烧完后取出.迅速将集气瓶口与另一装有酸性KMnO4溶液的集气瓶瓶口对接,振荡,发现红色KMnO4溶液颜色消失.