
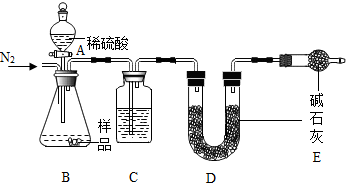
分析 (1)根据NaHCO3俗称为小苏打解答,根据碱石灰会吸收水分和二氧化碳进行分析;
(2)根据E的作用是防止空气中的水和二氧化碳进入D解答;
(3)根据碱石灰是碱性干燥剂,盐酸具有挥发性进行分析;
(4)根据实验时需要重复“加热、冷却、称量”操作多次,可以使碳酸氢钠完全分解进行分析;
(5)根据根据题目中的信息,写出NaHCO3完全分解的化学方程式解答;
(6)根据实验过程中减少的质量是水和二氧化碳的质量进行分析.
解答 解:
(1)NaHCO3俗称为小苏打;碱石灰会吸收水分和二氧化碳,实验在用碱石灰吸收二氧化碳之前,需要将气体干燥,C中盛放的物质是浓硫酸;
(2)E的作用是防止空气中的水和二氧化碳进入D,否则,若无装置E,在其他操作正确的情况下,不能准确测定样品中NaHCO3的质量分数,使测定结果偏大;
(3)碱石灰是碱性干燥剂,盐酸具有挥发性,会对所测数据造成影响,所以不能准确测定样品中NaHCO3的质量分数;
(4)实验时需要重复“加热、冷却、称量”操作多次,可以使碳酸氢钠完全分解;
(5)NaHCO3完全分解的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(6)实验过程中减少的质量是水和二氧化碳的质量,固体减少质量为:41.2g-35g=6.2g;
设样品中含有碳酸氢钠为x,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ 固体减少
168 62
x 6.2g
$\frac{168}{x}=\frac{62}{6.2g}$
x=16.8g
样品中碳酸氢钠为:41.2g-21.2g=20g
所以样品中NaHCO3的质量分数为:$\frac{16.8g}{20g}$×100%=84%.
答案:
(1)小苏打; 浓硫酸;
(2)不能;
(3)盐酸具有挥发性,D中的碱石灰既吸收生成的CO2,还会吸收挥发出的HCl气体,使测定结果偏大;
(4)使碳酸氢钠完全分解;
(5)2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(6)样品中NaHCO3的质量分数为84%.
点评 本题考查了碳酸钠的性质以及有关的计算,完成此题,可以依据已有的知识进行.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
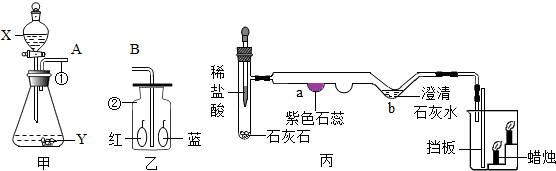
科目:初中化学 来源: 题型:推断题
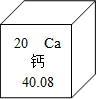 钙元素对人类生命和生活具有重要意义.
钙元素对人类生命和生活具有重要意义.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 A、B、C、D、E是初中化学常见的不同类别物质(单质、氧化物、酸、碱和盐),它们之间相互关系如图(“→”表示反应转化关系,“-”表示相互之间能反应,部分反应物、生成物以及反应条件省略).若往D、E两种溶液中分别滴入紫色石蕊试液,溶液均显蓝色;D与E两种溶液混合有白色沉淀产生;C与E的溶液反应有气泡产生,该气体能使澄清石灰水变浑浊.请回答下列问题:
A、B、C、D、E是初中化学常见的不同类别物质(单质、氧化物、酸、碱和盐),它们之间相互关系如图(“→”表示反应转化关系,“-”表示相互之间能反应,部分反应物、生成物以及反应条件省略).若往D、E两种溶液中分别滴入紫色石蕊试液,溶液均显蓝色;D与E两种溶液混合有白色沉淀产生;C与E的溶液反应有气泡产生,该气体能使澄清石灰水变浑浊.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
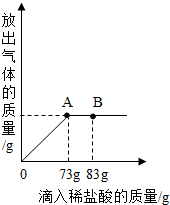 将碳酸钠和氯化钠的混合物加足量水溶解,制成131.4克溶液.向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示.当滴加稀盐酸至图中B点时,将溶液倒入蒸发皿中蒸发,最终称得固体的质量为25.6克.请根据题意回答问题:
将碳酸钠和氯化钠的混合物加足量水溶解,制成131.4克溶液.向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示.当滴加稀盐酸至图中B点时,将溶液倒入蒸发皿中蒸发,最终称得固体的质量为25.6克.请根据题意回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com