


科目:初中化学 来源: 题型:
| A、室内发生火灾时,打开所有门窗通风 |
| B、煤气泄漏时,打开电灯检查漏气管道 |
| C、地震发生时,底楼的同学快速跑到空旷的地方 |
| D、有人触电时立即用手把触电者拉开 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、木炭在氧气中燃烧,发出白光,生成黑色固体 |
| B、铁丝在氧气中燃烧,火星四射,生成黑色固体 |
| C、红磷在氧气中燃烧,产生大量的白雾 |
| D、硫在氧气中燃烧,产生淡蓝色火焰 |
查看答案和解析>>
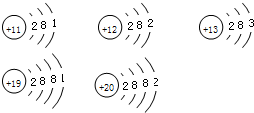
科目:初中化学 来源: 题型:
查看答案和解析>>
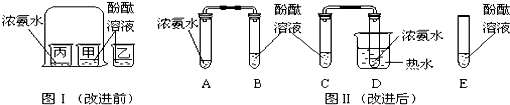
科目:初中化学 来源: 题型:
查看答案和解析>>
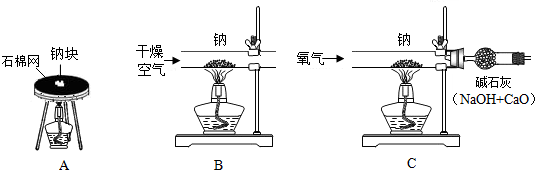
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体剩余物于试管中,向其中加入足量的稀盐酸,观察现象 | (1)固体部分溶解,溶液为无色. | 猜想①成立 |
| (2) | 猜想②成立 | |
| (3) | 猜想 ③成立 |
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com