
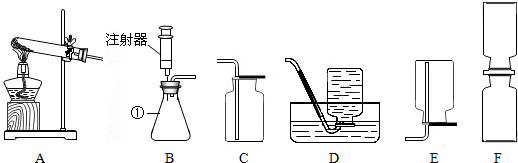
分析 (1)熟记仪器的名称;
(2)加热高锰酸钾属于固体加热型,故选发生装置A,收集纯净的气体用排水法,并据反应原理书写方程式;
(3)从分子的性质进行分析;
(4)根据制取气体的反应物状态、反应条件、气体的性质可以选择发生装置和收集装置.
解答 解:(1)仪器①是锥形瓶,故填:锥形瓶;
(2)加热高锰酸钾属于固体加热型,故选发生装置A,氧气不易溶于水,所以收集较纯净的氧气可用排水法,反应方程式是:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;故填:AD;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)一切物质的分子都在不停的运动,把密度大的气体放在上面,会使气体分子运动的速度加快,两种气体混合均匀的时间变短,所以将放在上方;抽去两瓶间的玻璃片,将会观察到上瓶气体颜色逐渐变浅,下瓶气体颜色逐渐加深,最后颜色相同;故填:上;上瓶气体颜色逐渐变浅,下瓶气体颜色逐渐加深,最后颜色相同;
(4)制取硫化氢时不需要加热,若要控制滴加液体的速率,可选择的发生装置是B;属锌和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑;在实验室中用锌和稀硫酸反应制取氢气,属于固液常温型,所以应该选择B装置来制取氢气;氢气密度比空气小,难溶于水,所以应该选择D或E装置来收集氢气.故填:B;BD或BE.
点评 该题考查了实验室制取气体的原理、方法、装置的选择,属于基础性的综合题,有利于学生掌握实验基础知识.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 组别 | 化学方程式 | 结论 |
| Ⅰ | 6CO2+6H2O$\frac{\underline{\;光照叶绿素\;}}{\;}$C6H12O6+6O2 CO2+H2O═H2CO3 | 反应物相同,生成物不同,原因反应条件不同. |
| Ⅱ | Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O | 反应物相同,生成物不同,原因反应物的浓度不同. |
| Ⅲ | C+O2(充足)$\frac{\underline{\;点燃\;}}{\;}$CO2 2C+O2(不充足)$\frac{\underline{\;点燃\;}}{\;}$2CO | 反应物相同,生成物不同,原因反应物的量不同. |
| Ⅳ | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑(反应缓慢) 2KClO3$\frac{\underline{\;二氧化锰\;}}{加热}$2KCl+3O2↑(反应迅速) | 反应物相同,生成物不同,原因有无催化剂. |
| 实践与应用 | 科学探究正努力实现对化学反应的控制,很多化学家致力于研究二氧化碳的“组合转化”技术,把过多二氧化碳转化为有益于人类的物质.若让二氧化碳和氢气在一定条件下反应,可生成一种重要的化工原料,反应的化学方程式如下: 2CO2+6H2$\frac{\underline{\;催化剂\;}}{△}$X+4H2O,推断X的化学式是C2H4. | |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
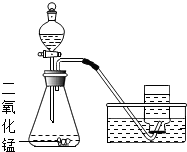 在氧气制取和检验实验中.
在氧气制取和检验实验中.| 集气瓶标号 | A | B | C | D | E |
| 氧气体积分数(%) | 80 | 70 | 65 | 60 | 55 |
| 铁丝燃烧状况 | 燃烧剧烈 | 燃烧较剧烈 | 燃烧不剧烈 | 燃烧较微弱 | 不燃烧,发红 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| FeCl3溶液 | FeSO4溶液 | |
| 滴入NaOH溶液的现象 | 生成红褐色沉淀 | 先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色沉淀. |
化学方程式 | 基本反应类型属于复分解反应 | FeSO4+2NaOH=Fe(OH)2↓+Na2SO4 4Fe(OH)2+2O2+H2O=4Fe(OH)3↓ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Na +、Cl -、H +、CO 3 2- | B. | Ag +、Ca 2+、NO 3-、Cl- | ||
| C. | NO 3-、OH -、Cu 2+、Na + | D. | K +、Mg 2+、Cl -、NO3- |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
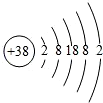 据《自然》杂志报道,科学家最近研究出一种以锶(Sr)做钟摆的钟,它是世界上最精确的钟,锶的原子结构示意图如图所示,请回答:
据《自然》杂志报道,科学家最近研究出一种以锶(Sr)做钟摆的钟,它是世界上最精确的钟,锶的原子结构示意图如图所示,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com