
| 序号 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
| 第1次 | 20 | 11 |
| 第2次 | 20 | 6 |
| 第3次 | 20 | 2.8 |
| 第4次 | 20 | n |
分析 (1)根据图表数据可知,第1、2次反应后固体物质减少的质量都为5g,而第3次反应后固体物质减少的质量为3.2g,说明此时碳酸钙已反应完,不再产生气体,故表中n的数值为2.8.
(2)根据图表数据可知,完全反应后,剩余固体物质的质量为2.8g,石灰石样品的质量减去剩余固体物质的质量就是样品中碳酸钙的质量,然后根据质量分数公式计算即可.
(3)根据图表数据可知,第1、2次反应后固体物质减少的质量都为5g,说明20g稀盐酸恰好能与石灰石中的5g碳酸钙完全反应.根据碳酸钙与盐酸反应的化学方程式和第1次完全反应中碳酸钙的质量,即可计算出第一次参与反应的HCl质量,然后根据溶质的质量分数公式计算即可.
解答 解:(1)根据图表数据可知,第1、2次反应后固体物质减少的质量都为5g,而第3次反应后固体物质减少的质量为3.2g,说明此时碳酸钙已反应完,不再产生气体,故表中n的数值为2.8.
故答案为:2.8.
(2)样品中碳酸钙的质量分数=$\frac{16g-2.8g}{16g}×100%$=82.5%.
答:样品中碳酸钙的质量分数为82.5%.
(3)由试题分析20g稀盐酸恰好能与石灰石中的5g碳酸钙完全反应
解:设第一次参与反应的HCl质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
5g x
∴$\frac{100}{5g}=\frac{73}{x}$,
解之得:x=3.65g,
盐酸中溶质的质量分数为:$\frac{3.65g}{20g}×100%$=18.25%.
答:盐酸中溶质的质量分数为18.25%.
解:(1)设与粗产品中碳酸钠反应消耗的氯化氢的质量为x.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
73 44
x 0.44g
$\frac{73}{x}=\frac{44}{0.44g}$
x=0.73g
(2)36.5g 20%盐酸溶液中含氯化氢的质量为:36.5g×20%=7.3g
与粗产品中氢氧化钠反应消耗氯化氢的质量为:
7.3g一0.73g=6.57g
设粗产品中含氢氧化钠的质量为y.
NaOH+HCl=NaCl+H2O
40 36.5
y 6.57g
$\frac{40}{y}=\frac{36.5}{6.57g}$
y=7.2g
粗产品中含氢氧化钠的质量分数为:7.2g/10g×100%=72.0%.
点评 本题主要考查学生利用化学方程式和溶质的质量分数公式进行计算的能力.


科目:初中化学 来源: 题型:实验探究题
 Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH→A↓+NaCl,则A沉淀是.由于Fe(OH)2不稳定,在水中只要有一点氧气就极易发生反应生成Fe(OH)3,写出其反应的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3,因而在溶液中较难制得纯净的Fe(OH)2.若按照常规的正确方法向FeCl2溶液中滴加NaOH溶液,很难观察到白色沉淀的现象,只能看到灰绿色沉淀.用下面两种精心设计的方法可以制得白色的Fe(OH)2沉淀.
Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH→A↓+NaCl,则A沉淀是.由于Fe(OH)2不稳定,在水中只要有一点氧气就极易发生反应生成Fe(OH)3,写出其反应的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3,因而在溶液中较难制得纯净的Fe(OH)2.若按照常规的正确方法向FeCl2溶液中滴加NaOH溶液,很难观察到白色沉淀的现象,只能看到灰绿色沉淀.用下面两种精心设计的方法可以制得白色的Fe(OH)2沉淀.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
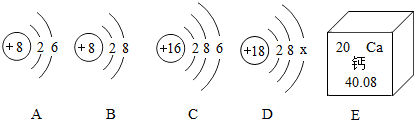
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 同学们在复习时构建了如图所示的知识网络,“-”表示相连物质在一定条件下可以发生反应.请回答下列问题:
同学们在复习时构建了如图所示的知识网络,“-”表示相连物质在一定条件下可以发生反应.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
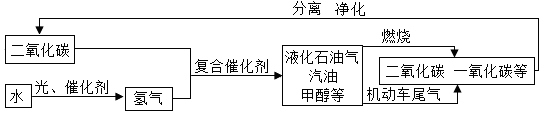
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 加热蒸发溶剂后,再降至原温度 | B. | 加入一定量的硝酸钾 | ||
| C. | 降温至溶液刚好达到饱和 | D. | 降温后使其析出部分晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com