
向一定量的含有盐酸的氯化铁溶液中逐滴加入氢氧化钠溶液.下列图象中能正确表示滴入氢氧化钠溶液的质量
(W(g))与产生沉淀的质量(Q(g))关系是[ ]

科目:初中化学 来源: 题型:阅读理解
 (2013?海淀区一模)当前市售珍珠粉的价格从五元到上百元不等,但其外观、手感都没有明显差异.
(2013?海淀区一模)当前市售珍珠粉的价格从五元到上百元不等,但其外观、手感都没有明显差异.| 实验内容 | 现象 | 结论 |
| (1)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,静置一段时间后,滴加 酚酞试液 酚酞试液 . |
廉价珍珠粉的上层清液变红,优质珍珠粉的溶液没有变色 | 猜想①成立 |
| (2)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,加热. | 优质珍珠粉的溶液有黄色出现,局部变黑,廉价珍珠粉的溶液没有明显现象 | 猜想②成立 |
| 优质珍珠粉 | 廉价珍珠粉 | |
| 珍珠粉的质量 | 100 g | 100 g |
| 加入盐酸的质量 | 460.0 g | 501.3 g |
| 烧杯中最终物质的总质量 | 520.0 g | 557.7 g |
查看答案和解析>>
科目:初中化学 来源:初三化学(中学生学科素质训练与检测丛书) 题型:013
向一定量的含有盐酸的氯化铁溶液中逐滴加入氢氧化钠溶液.下列图象中能正确表示滴入氢氧化钠溶液的质量(W(g))与产生沉淀的质量(Q(g))关系是
[ ]

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 含钠元素、钙元素的化合物是初中化学的重要研究对象之一.
含钠元素、钙元素的化合物是初中化学的重要研究对象之一.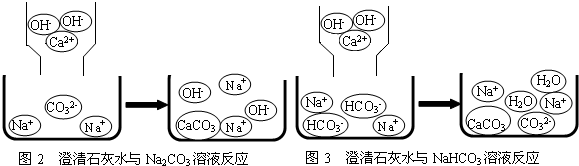
| 实验内容 | 实验现象 | 实验结论 |
| 方案一:取少量滤液加入试 管中,向其中______ | ______ | 娇娇同学的猜想是正确的. 滤液中含有的两种溶质是 ______ |
| 方案二:取少量滤液加入试管中,向其中______ | ______ |
 学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议______
学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议______查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量样品置于试管中,加足量的水溶解,观察并用手触摸试管外壁 | 形成浊液 试管外壁发热 | 则样品中CaO 和______ 至少有一种 |
| ②将①的浊液过滤,向所得的滤液中逐滴加入氯化钙溶液至过量 | 产生白色沉淀 | 样品中含有的物质是______ |
| ③将②的浊液过滤,向所得的滤液中滴加几滴酚酞溶液 | 溶液______ | 由步骤①可知:最后滤液一定显碱性, 因此无法检验样品中的Ca(OH)2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com