
 人体缺乏维生素C(简写“Vc”)会患坏血病.如图所示为某种“维生素C”说明书的一部分,请计算:
人体缺乏维生素C(简写“Vc”)会患坏血病.如图所示为某种“维生素C”说明书的一部分,请计算:分析 (1)①根据正常成人每天需要Vc的最低量及标签中每片药片中Vc含量、服用方法,计算每少的服用量;
②根据正常成人每天需要Vc的最低量及新鲜蔬菜中Vc含量,计算每少的食用该蔬菜的量;
(2)根据Vc化学式的含义、相对分子质量为构成分子的各原子的相对原子质量之和、1个维生素C分子的构成进行分析解答.
(3)根据标签中维生素C的化学式,利用各元素的相对原子质量进行计算;
(4)根据维生素C的化学式判断计算“Vc”中C元素的质量分数.
解答 解:(1)维生素C中C、H、O三种元素的质量比=(12×6):(1×8):(16×6)=9:1:12;
(1)①每片维生素C片的质量为Vc100mg,含“Vc”10%,则每片维生素C片中含“Vc”的质量为100mg×10%=10mg;若正常成人每天对“Vc”的最低需要量为60mg,一日服用三次,则每次服用“维生素C”至少60mg÷10mg÷3=2片;
②含60mgVc的新鲜蔬菜的质量=$\frac{60mg}{120mg}$×1000g=500g;
(2)Vc是由碳、氢和氧三种元素组成的;Vc的相对分子质量为:12×6+1×8+16×6=176;
(3)“Vc”中C、H、O三种元素的质量比是:(12×6):(1×8):(16×6)=9:1:12;
(4)“Vc”中氧元素的质量分数为:$\frac{16×6}{12×6+1×8+16×6}$×100%=54.5%.
点评 运用化学计算解决生活实际问题,体现化学与生活的联系,感觉化学就在我们身边.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:初中化学 来源: 题型:选择题
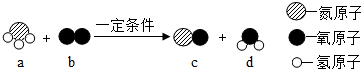
| A. | 该反应属于化合反应 | B. | 氧原子的结构示意图为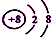 | ||
| C. | b,d两种物质均由分子组成 | D. | a物质中氮元素的化合价为+3价 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
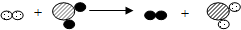 已知某两种物质在一定条件下能发生化学反应,其反应的微观示意图如图,则下列说法中,正确的是( )(说明:一种小球代表一种元素的原子)
已知某两种物质在一定条件下能发生化学反应,其反应的微观示意图如图,则下列说法中,正确的是( )(说明:一种小球代表一种元素的原子)| A. | 反应物是一种单质和一种化合物 | |
| B. | 反应物的总质量一定等于生成物的总质量 | |
| C. | 该反应属于分解反应 | |
| D. | 该反应不符合质量守恒定律 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 向烧杯中逐滴加入X溶液至过量(图甲),生成沉淀或气体的质量(纵坐标)与加入X溶液的质量(横坐标)关系不符合图乙的是C.
向烧杯中逐滴加入X溶液至过量(图甲),生成沉淀或气体的质量(纵坐标)与加入X溶液的质量(横坐标)关系不符合图乙的是C.| 烧杯中的物质 | X溶液 | |
| A | 稀硫酸和稀盐酸 | 氯化钡溶液 |
| B | 澄清石灰水 | 碳酸钠溶液 |
| C | 稀硫酸光和硫酸铜溶液 | 氢氧化钠溶液 |
| D | 碳酸钠和氢氧化钠溶液 | 稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com