

| 溶液 | 白醋 | 盐酸 | 蔗糖水 | 草木灰水 | 石灰水 |
| 加入紫薯汁后的颜色 | 红色 | 红色 | 紫色 | 绿色 | 绿色 |
科目:初中化学 来源: 题型:解答题
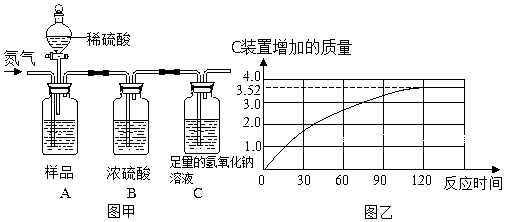
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
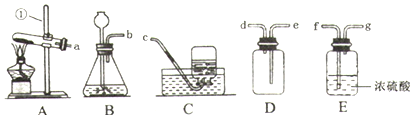
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 若将t1℃时的甲、乙的饱和溶液升温至t2℃时,乙溶液中溶质的质量分数将大于甲溶液中溶质的质量分数 | |
| B. | t2℃时,甲、乙的饱和溶液中含有的溶质质量甲等于乙 | |
| C. | 若将t3℃的甲、乙的饱和溶液分别降温到t2℃时,甲、乙两溶液中均有晶体析出 | |
| D. | 当甲中混有少量乙时,可采用冷却热饱和溶液的方法提纯 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯化钠、食盐、Na2CO3 | B. | 氢氧化铁、铁锈、Fe(OH)3 | ||
| C. | 氢氧化钠、烧碱、NaOH | D. | 碳酸钙、生石灰、CaCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ②③⑤⑥ | B. | ①③⑤⑥ | C. | ①③④⑥ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
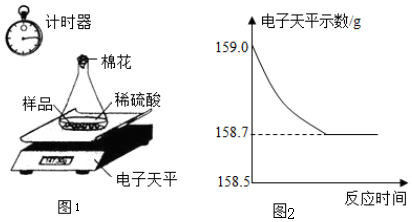

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 溶液的温度/℃ | 50 | 40 | 30 | 20 |
| 析出固体的质量/g | 0 | 0 | 2.0 | 8.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
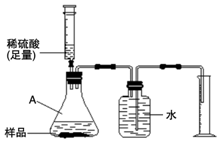 侯德榜是我国著名的化学家.由他发明的侯氏制碱法制得的纯碱中含有少量氯化钠杂质.某化学兴趣小组的同学为了测定该厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),设计了如下两种实验方案
侯德榜是我国著名的化学家.由他发明的侯氏制碱法制得的纯碱中含有少量氯化钠杂质.某化学兴趣小组的同学为了测定该厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),设计了如下两种实验方案查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com