
 ×100%=36.8%
×100%=36.8%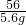 =
=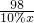


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2010?韶关)在现代生活中,人们越来越注重微量元素摄取.碘元素对人体有着至关重要的作用.右图是某地市场销售的一种“加碘食盐”包装袋上的部分说明.
(2010?韶关)在现代生活中,人们越来越注重微量元素摄取.碘元素对人体有着至关重要的作用.右图是某地市场销售的一种“加碘食盐”包装袋上的部分说明.查看答案和解析>>
科目:初中化学 来源: 题型:
 在现代生活中,人们越来越注重微量元素的摄取.碘元素对人体有着至关重要的作用.右图是某地市场销售的一种“加碘食盐”包装袋上的部分说明.
在现代生活中,人们越来越注重微量元素的摄取.碘元素对人体有着至关重要的作用.右图是某地市场销售的一种“加碘食盐”包装袋上的部分说明.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 在现代生活中,人们越来越注重微量元素摄取.碘元素对人体有着至关重要的作用.
在现代生活中,人们越来越注重微量元素摄取.碘元素对人体有着至关重要的作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com