
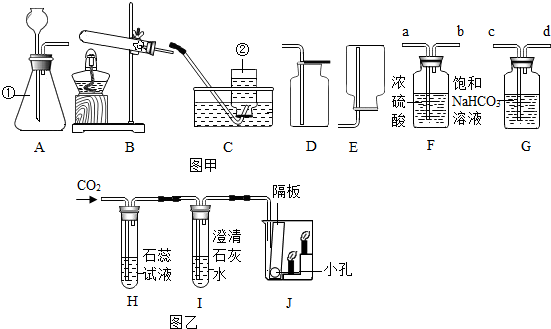
分析 (1)根据常见的化学仪器的名称进行分析解答.
(2)根据实验室中制取二氧化碳的反应原理和反应条件来选择反应的发生装置,根据二氧化碳的密度及水溶性来选择收集装置;检验二氧化碳使用澄清的石灰水,据此进行分析解答.
(3)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,大理石和石灰石的主要成分是碳酸钙,通常情况下,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;
饱和碳酸氢钠溶液能和氯化氢反应生成氯化钠、水和二氧化碳;浓硫酸具有吸水性,可以用来干燥二氧化碳;
(4)二氧化碳与水反应生成碳酸,碳酸可使紫色石蕊试液变红,二氧化碳与澄清石灰水的主要成分氢氧化钙反应生成碳酸钙沉淀和水,并据现象分析其性质.
解答 解:(1)仪器①的名称是锥形瓶.
(2)在实验室中制取二氧化碳常用大理石或石灰石和稀盐酸反应来制取,属于固液常温型,所以应该选择B装置来制取二氧化碳气体;实验室常用石灰石与稀盐酸反应制取二氧化碳,同时生成氯化钙、水,反应的化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;常用澄清的石灰水检验二氧化碳气体,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
(3)实验室用石灰石和稀盐酸制取二氧化碳气体时不需要加热,发生装置可选择图中的B装置;
为获得纯净、干燥的二氧化碳气体,导管口连接的正确顺序是:气体通过c导管进入饱和碳酸氢钠溶液中,除去氯化氢气体后,通过d导管导出,再通过a导管进入浓硫酸中,除去水蒸气后通过b导管导出.故填:c;d;a;b
(4)二氧化碳与水反应生成碳酸,碳酸可使紫色石蕊试液变红,二氧化碳与澄清石灰水的主要成分氢氧化钙反应生成碳酸钙沉淀和水,反应方程式是:Ca(OH)2+CO2=CaCO3↓+H2O;H中观察到蜡烛由低到高依次熄灭,说明二氧化碳密度比空气大,并且不能燃烧、不能支持燃烧;
故答案为:
(1)锥形瓶;(2)A;CaCO3+2HCl=CaCl2+H2O+CO2↑;将气体通入澄清的石灰水中,观察是否变浑浊;
(3)→( c)→( d)→( a)→( b).
(4)紫色石蕊试液变红; Ca(OH)2+CO2=CaCO3↓+H2O;二氧化碳密度比空气大,并且不能燃烧、不能支持燃烧.
点评 本题难度不大,是中考的重要考点之一,熟练掌握实验室中制取气体的反应原理、发生装置和收集装置的选择依据是正确解答本题的关键.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气占空气质量的21% | |
| B. | 好酒不怕巷子深,是由于分子的不断运动 | |
| C. | 催化剂在化学变化前后质量和性质保持不变 | |
| D. | 氧气可用于食品保鲜 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 物质 | A | B | C | D |  氮原子 氮原子 氧原子 氧原子 氢原子 氢原子 |
| 微观示意图 |  |  |  |  | |
| 反应前质量/g | 100 | 20 | X | y | |
| 反应后质量/g | 32 | 140 | 126 | 46 |
| 温度(℃) | 25 | 350 | 400 | 500 | 600 | 900 |
| 固体质量(g) | 0.80 | 0.80 | 0.40 | 0.44 | 0.44 | 0.43 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只含碳、氢元素 | B. | 一定含碳、氢元素,可能含有氧元素 | ||
| C. | 一定含碳、氢、氧元素 | D. | 含有元素无法判断 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com