
分析 根据质量守恒定律的应用确定氧气的质量,而后利用氧气的质量利用化学方程式进行计算,可求出氯化钾的质量.
解答 解:(1)依据质量守恒定律可知:制得氧气的质量:30g-20.4g=9.6g;
(2)剩下固体含有氯化钾(KCl)和二氧化锰(MnO2),则设剩下固体中KCl的质量为x,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
149 96
x 9.6g
$\frac{149}{x}$=$\frac{96}{9.6g}$
x=14.9g
答:(1)可制得氧气的质量是9.6g;
(2)剩余固体中含有氯化钾的质量是14.9g.
点评 此题是依据质量守恒定律的应用解答问题,解题的关键是化学方程式的计算,属基础性计算解答题.


科目:初中化学 来源: 题型:选择题
| A. | CuO(铜粉)--加入过量的稀硫酸,过滤 | |
| B. | CO2(HCl)--通入足量的NaOH溶液,干燥 | |
| C. | CaCl2溶液(HCl)--加入过量的碳酸钙粉末,过滤 | |
| D. | CuCl2溶液(Na2SO4)--加入适量的Ba(OH)2溶液,过滤 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
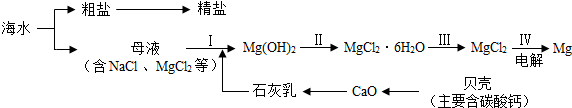
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
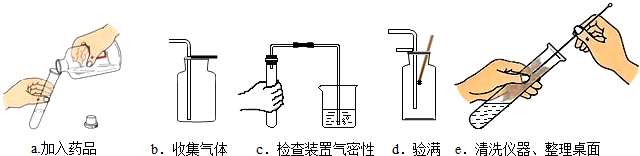
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
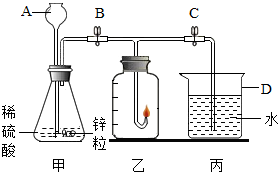 某化学兴趣小组的同学准备用氢气燃烧法测定空气中氧气的体积分数,设计的实验装置如图:
某化学兴趣小组的同学准备用氢气燃烧法测定空气中氧气的体积分数,设计的实验装置如图:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com