
����Ŀ�����������������ʱ�������й�����������չ��������·������������Ϊ���ǵij����ṩ�˷��㡣�й��ĸ������������������й���Ҳ�ս��츣��ȫ���ࡣ�����Żش��������⣺

��1�������������ij��������ܶ�С������ʴ�Ժõ����ʣ�Ӧѡ��ĺϽ�_____������A��B��C��ѡ�
A �̸� B ���Ͻ� C �����
��2�������ڹ��������е�����ת��Ϊ_____��
��3����������ʱ�ĽӴ�������ͭ��ͭ�Ͻ��ߣ�������ͭ�ǵ�������ͭ����Ҫ������������Ҫ��һ������������ͭ��Cu2O��������ͭ��Cu2S�����·�Ӧ���ɸߴ��ȵ�ͭ��һ����̬������Ⱦ�������Ӧ�Ļ�ѧ����ʽ��_____���÷�Ӧǰ��ͭԪ�صĻ��ϼ۱仯Ϊ_____��
��4�������Ľ��ɽ������еĽ�ͨѹ��������������������������Ⱦ����ŷţ���һ����̼��δȼ�յ�̼�⻯���_____����Ǧ�����_____��
���𰸡�B ����ת��Ϊ��е�� 2Cu2O+Cu2S![]() 6Cu+SO2�� +1�ۡ�0�� ���������� �̳�
6Cu+SO2�� +1�ۡ�0�� ���������� �̳�
��������
��1�����Ͻ�ʴ�Ժã��ܶ�С������Ҫ��Ͻ���Ͽ���ʴ���ܶ�С�����B��
��2����������ͨ���ǵ���������������ʻ�����е�����ת���ǵ���ת��Ϊ��е�ܣ��������ת��Ϊ��е�ܣ�
��3�����������Ϣ�Լ�Ԫ���غ��֪�������ɶ����������塣�ڻ������и�Ԫ���������ϼ۵Ĵ�����Ϊ�㣬������ͭ��Cu2O���У���Ԫ���ԩ�2�ۣ�������ͭԪ����+1�ۣ�����ͭ��Cu2S���У���Ԫ���ԩ�2�ۣ�������ͭԪ����+1�ۣ�ͭ���ڵ��ʣ�������Ԫ�صĻ��ϼ�Ϊ�㡣���2Cu2O+Cu2S ![]() 6Cu+SO2����+1�ۡ�0�ۣ�
6Cu+SO2����+1�ۡ�0�ۣ�
��4������β���к���δȼ�յ�̼�⻯���һ����̼�������������Ǧ����������̳��ȣ��������������̳���


 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҷֱ��ú��ף����� ab���Ͱ��ף����� ac��ȼ�ղⶨ�ܱ������������ĺ�����ʵ�� ��������������������õ��ܱ�����������Ũ����ͼ��ʾ����ش��������⣺
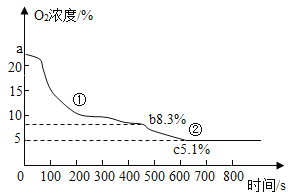
��1������ȼ�յķ���ʽ��ʲô��__________
��2������ȼ����������������__________�������� ��������С�������������������ף���ͳȼ�պ� �ķ�������ȷ�ⶨ����������������ԭ ����ʲô��__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ǽס��ҵ��ܽ�����ߣ�����˵����ȷ����
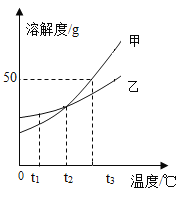
A.t2��Cʱ�� �ס���������Һ���ʵ������������
B.��t3��Cʱ�ס��ҵı�����Һ������t2��Cʱ�����ľ���״���
C.t1��Cʱ���������ļף���ǡ����ȫ�ܽ��γɵ���Һ�������״�����
D.t3��Cʱ�� �ı�����Һ��������������Ϊ50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ���ֲ�ͬŨ�ȵ�����������Һ���ӦŨ�ȵ����ᷴӦ�����ߡ�

����˵����ȷ����
A. ��a��b��c����������ʾ��ʵ���У���������Ũ��Խ��Vʱ������Һ��pHԽ��
B. ��a������ʾ��ʵ���У����÷�̪��ָʾ������̪��Һ�ɺ�ɫ��Ϊ��ɫ
C. ��a��b��c����������ʾ��ʵ���У���Ӧ������ͬ
D. ��a��b��c����������ʾ��ʵ���У���Һ������ǿ������˳����a>b>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ�о�С���������ȷֽ��������̽����
[̽��һ]��һС��ͨ����������������̽�������Ƴ�����Ũ�����¶ȵı仯��ͼ��ʾ��
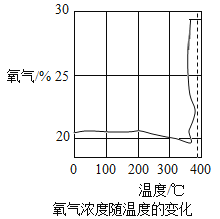
�������ϣ�KClO3���۵�ԼΪ356��C��MnO2�ķֽ��¶�ԼΪ535��C���þƾ��Ƹ����ʼ��ȣ��������ʵ��¶�һ��ԼΪ400��C���ң���ͼ�п�֪��KClO3�ֽ��¶�_____(�>������=����<��)���۵㡣��KCIO3�ֽ�ǰ���������õ�����Ũ�Ƚ��͵Ŀ���ԭ����____��
[̽����]�ڶ�С�鷢�֣������������ͭ��ϼ��ȣ�Ҳ�ܽϿ�������������ǣ����±�����ʵ��̽�������ⶨ�ֽ��¶ȡ�
ʵ���� | ʵ����Ʒ | �ֽ��¶� |
�� | 3.0g����� | 580 |
�� | 3.0g����غ�1.0g�������� | 350 |
�� | xg����غ�1.0g����ͭ | 370 |
(1)ʵ��3��x��ֵӦΪ_____���ɶԱ�ʵ��____(����)��֤������ͭҲ��ӿ�����صķֽ⣬����Ч�����õ�������_____��
(2)��̽��������ͭ������һ����������طֽ����ʹ�ϵ��ʱ���ó��й�ʵ����������:
����ͭ������ص������� | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
����1L���������ʱ��(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
�������ݣ�����ͭ������ص�������Ϊ____ʱ����Ӧ������졣��ˣ��ڻ�ѧ��Ӧ�д���������_____ (��ǡ����ǡ�)Խ��Խ�á�
[̽����]����С����������غͶ���������ȡ����ʱ���������ɵ������Դ���ɫ�����д̼�����ζ��
������⣺���ɵ������г������������ʲô����?
�������ϣ��ٳ����£������ǻ���ɫ�����������ǻ�ɫ������ǿ�Ҵ̼�����ζ�����壻
�ڶ������Ⱦ���ǿ�����ԣ�������������Һ��Ӧ���ɲ�����ˮ�Ķ������̣����������ܡ�
������裺
����1����������������2�����ж������ȡ�
���ʵ�飺
ʵ�鲽�� | ʵ������ | ʵ����� |
____ | _____ | ����2��ȷ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2018��5��18���ҹ���һ�ҹ�����ĸ�Ժ��ɹ�����ĸ���������Ԫ��ʹ���˻�ͭ��Ϊ�ⶨij��ͭ(����Ͻ��н���ͭ��п)��ͭ��������������ȤС��ͬѧ��ȡ20g��ͭ��ĩ���ձ��У���80gϡ������Ĵμ��룬��ַ�Ӧ�����ʵ���������±���ʾ:
��һ�� | �ڶ��� | ������ | ���Ĵ� | |
����ϡ���������(g) | 20 | 20 | 20 | 20 |
�ձ���ʣ���������(g) | 39.92 | 59.84 | 79.80 | 99.80 |
(1)��ͭ��ĩ��ȫ��Ӧ����������������Ϊ_______g��
(2)�û�ͭ��ͭ����������Ϊ����____________? (д���������)
(3)������ʵ�������ʵ�����Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij��Ӧ����ʾ��ͼ������˵����ȷ����
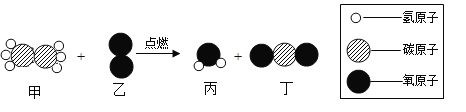
A.�÷�Ӧ�мס����������л���
B.��Ӧ���ɱ��������Ӹ�����Ϊ3:2
C.�μӷ�Ӧ�ļס��ҵ�������Ϊ30:32
D.�÷�Ӧ�����û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʢ����÷����÷�к��зḻ��Ҷ�ᣬ�Է��������л������ã��仯ѧʽΪCl9Hl9N7O6�������й�Ҷ���˵������ȷ����
A. Ҷ�����Է�������Ϊ441 g
B. Ҷ���е�Ԫ�ص���������������Ԫ�ص���������
C. Ҷ����̼���⡢����������Ԫ��������Ϊ19��19��7��6
D. Ҷ����19��̼ԭ�ӡ�19����ԭ�ӡ�7����ԭ�Ӻ�6����ԭ�ӹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ѧ���ű�ʾ��
��1������____
��2��1������������____
��3��2��������____
��4���Ȼ�����__
��5��������![]() ����ʾ��ԭ�ӣ����з����У����û�ѧ���ű�ʾ��
����ʾ��ԭ�ӣ����з����У����û�ѧ���ű�ʾ��
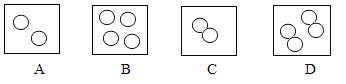
��A��_____
��C��____
��6���ؿ��к������Ľ���Ԫ�غͺ������ķǽ���Ԫ����ɻ�����Ļ�ѧʽ______
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com