
分析 根据物质是由元素组成的、溶液的酸碱性与pH的关系、化学变化时有新物质生成、离子中各元素的化合价之和等于离子的化合价、以及化学反应前后元素的种类和原子的个数不变进行确定物质的化学式即可.
解答 解:(1)物质是由元素组成的,故这里的镉、铅指的是元素,故填:C;
(2)实验室用pH试纸测得自来水的pH=6,pH小于7的溶液呈酸性,故说明该自来水显酸性,故填:酸;
(3)①臭氧(O3)在消毒过程中转化为氧气,生成了新的物质,故臭氧转化为氧气属于化学变化,故填:化学;
②ClO-的化合价为-1,氧元素的化合价为-2,设氯元素的化合价为x,则有x+(-2)=-1,故x=+1,故填:+1;
③由于化学反应前后各原子的种类和个数不变,依据反应的化学方程式NH2Cl+X═NH3+HClO,反应前含有1个N原子,2个H原子,1个Cl原子和X,反应后含有1个N原子,4个H原子,1个Cl原子,1个O原子,故X中含有2个H原子和1个O原子,故其化学式为H2O,故填:H2O.
点评 本题考查的是物质的组成和质量守恒的知识,完成此题,可以依据已有的知识进行.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:初中化学 来源: 题型:实验探究题

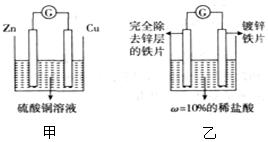
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 炒菜时油锅着火,可立即加水灭火 | |
| B. | 发现煤气泄漏应立即关阀门开窗通风 | |
| C. | 不要用湿手接触带电体,以免发生触电危险 | |
| D. | 不能用甲醛浸泡食品进行保鲜 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
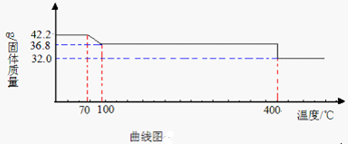
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
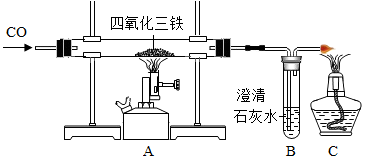
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
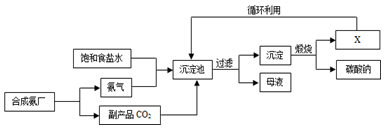
| A. | 沉淀池中的反应物共含有4种元素 | |
| B. | 通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀 | |
| C. | 图中X可能是氨气 | |
| D. | 过滤得到的“母液”中一定只含有两种溶质 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 探究内容 | 探究方法 | 探究现象 |
| 温度 对硝酸钾固体溶解快慢的影响 | ①取两个烧杯,分别加入l0mL等温的水 ②再分别加入l g同样颗粒大小的硝酸钾固体 ③给其中一个烧杯加热 | 被加热的烧杯里的硝酸钾固体完全溶解用得时间短 |
| 搅拌对硝酸钾固体溶解快慢的影响 | ①取两个烧杯,分别加入l0mL等温的水 ②再分别加入l g同样颗粒大小的硝酸钾固体 ③搅拌其中一个烧杯里的硝酸钾固体 | 搅拌的烧杯里的硝酸钾固体完全溶解用得时间短 |
| 颗粒大小对硝酸钾固体溶解快慢的影响 | ①取两个烧杯,分别加入l0mL等温的水 ②向其中一个烧杯加入l g颗粒大的硝酸钾固体,向另一个烧杯加入l g粉末状的硝酸钾固体 | 颗粒小的硝酸钾固体完全溶解用得时间短 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 如图所示是晓星将一定质量的铁铁粉加入到100g稀硫酸溶液中,反应进行的时间和产生的气体的质量之间的关系图象.求:(忽略气体溶解度)
如图所示是晓星将一定质量的铁铁粉加入到100g稀硫酸溶液中,反应进行的时间和产生的气体的质量之间的关系图象.求:(忽略气体溶解度)查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样品于试管中,加入 足量的稀盐酸 | 猜想②正确;相关的化学反应方程式: Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com